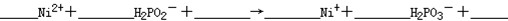-
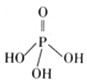
在福岛核泄漏事故中,检测到的放射性物质包括碘—131、铯—137和钚—239等。硼具有阻止反应堆内核分裂,降低反应堆温度的功能。下列说法正确的是( )
A.钚—239的质子数为239 B.氢氧化铯的碱性比氢氧化钾强
C.碘元素的相对原子质量为131 D.硼酸的酸性比铝酸(氢氧化铝)弱
难度: 简单查看答案及解析
-
在化学学习与研究中类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.SO2能与碱反应,推测:非金属氧化物都能与碱反应
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C.Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D.F-Cl-Br-I的单质熔点依次升高,推测:N-P-As-Sb-Bi的单质熔点也依次升高
难度: 简单查看答案及解析
-
X、Y元素均为主族元素,
和
的电子层结构相同,则下列说法中不正确的是
A.Y元素的核电荷数
等于
B.Y的原子序数小于X的原子序数
C.
的离子半径小于
的离子半径
D.若X元素位于
周期,则Y元素位于
周期
难度: 简单查看答案及解析
-
对于敞口容器中的化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ,下列叙述
不正确的是
A.锌不能用来表示该反应的速率,其它反应物和生成物都能用来表示该反应的速率
B.反应过程中能量关系可用下图表示

C.若将该反应设计成原电池,锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出标况下11.2L气体
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.将氢碘酸加到Fe(OH)3胶体中:Fe (OH)3 +3H+=Fe3++3H2O
B.碳酸氢钙溶液中加入少量烧碱:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.新制氯水中滴入少量溴化亚铁溶液:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.锌与1mol«L-1HNO3溶液反应:Zn+2H+= Zn2++H2↑
难度: 简单查看答案及解析
-
下列物质能用化合反应直接制得的是①FeC12 ②Fe(OH)3 ③NaHSO3 ④Fe(OH)2
A.①②③④ B.①②③ C.②③ D.②
难度: 简单查看答案及解析
-
下表为元素周期表前四周期的一部分,下列有关A、B、C、D、E、F六种元素的叙述正确的是
A
B
C
D
E
F
A.常压下六种元素的单质中,F单质的沸点最高
B.晶体E中不存在化学键
C.D元素的非金属性比B元素的非金属性强
D.单质A、C均没有同素异形体
难度: 简单查看答案及解析
-
mA(g)+nB(g)
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
①体系的压强不再改变 ②绝热体系的温度不再改变 ③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率vA: vB: vC: vD = m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥
难度: 简单查看答案及解析
-
下列有关物质性质的比较正确的为 ( )
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Cl->Br-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.①③ B.②④
C.③⑥ D.⑤⑥
难度: 简单查看答案及解析
-
下列各组反应中,第一个反应放出的热量比第二个反应放出的热量多的是(g、l、s分别表示气体、液体、固体)
A.
B.
C.
D.
难度: 简单查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
B.若X(OH)n为强碱,则Y(OH)n也一定为强碱
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
难度: 简单查看答案及解析
-
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是( )
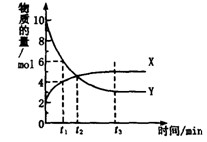
A 反应的化学方程式为5Y
X
B t1时,Y的浓度是X浓度的1.5倍
C t2时,正、逆反应速率相等
D t3时,逆反应速率大于正反应速率
难度: 简单查看答案及解析
-
进行如下实验,在A锥形瓶中放入10g绿豆大小的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50mL 1mol/L盐酸,下图中能正确表示实验结果的是( )
(注:x一时间、y-锥形瓶中碳酸钙减少的质量)
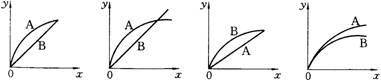
A B C D
难度: 简单查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)

A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
难度: 简单查看答案及解析
-
把3 mol A和2.5 mol B混合于2 L密闭容器中,发生反应:3A(g)+B(g)
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论错误的是 ( )
A.A的平均反应速率为0.15 mol/(L·min)
B.平衡时,C的浓度为0.25 mol/L
C.平衡时,B的转化率为20%
D.平衡时,容器内压强为原来的0.8倍
难度: 简单查看答案及解析
-
实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法:
。
反映上述反应有关的离子方程式错误的是
A.2Al+2OH—+2H2O=2AlO2—+3H2↑ B.HCO3—+AlO2—+H2O=CO2↑+Al(OH)3↓
C.NH4++AlO2—+2H2O=NH3·H2O+ Al(OH)3↓ D.3H++Al(OH)3=Al3++3H2O
难度: 简单查看答案及解析