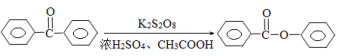-
《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理的方针。下列做法不正确的是( )
A. 面粉生产车间应严禁烟火 B. NH3泄露时向空中喷洒水雾
C. 含Cl2的尾气用碱溶液处理后再排放 D. 金属钠失火时应立即用大量冷水扑灭
难度: 简单查看答案及解析
-
下列有关钠元素及其化合物的表示正确的是( )
A. 钠原子的结构示意图:
B. 过氧化钠的电子式:
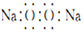
C. 小苏打在水中的电离方程式:NaHCO3=Na++HCO3-
D. 硫化钠的水溶液呈碱性的原因:S2-+2H2O
H2S+2OH-
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A. 氨气具有还原性,可用作制冷剂 B. 氢氟酸具有弱酸性,可用于蚀刻玻璃
C. 浓硫酸具有脱水性,可用于干燥CO2 D. 二氧化氯具有强氧化性,可用来漂白织物
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次递增,四种原子最外层电子数之和为18, X与Z同主族,Y原子的最外层电子数等于周期数,W的单质在常温下为气体。下列说法正确的是( )
A. 原子半径的大小顺序:r(Z)>r(Y)>r(X)
B. 简单氢化物的稳定性:W>Z
C. 元素X的单质只存在两种同素异形体
D. X、Y、W最高价氧化物对应的水化物两两之间能发生反应
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 向 H2O中通人 NO2:3NO2+H2O=H++NO3-+2NO
B. 向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O=H2SiO3↓+2Na++SO32-
C. 用饱和纯碱溶液洗涤试管中残留的苯酚:CO32-+2
2
+CO2↑+H2O
D. 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-= 3BaSO4↓+2Fe(OH)3↓
难度: 中等查看答案及解析
-
探究浓硫酸和铜的反应,下列装置或操作正确的是( )
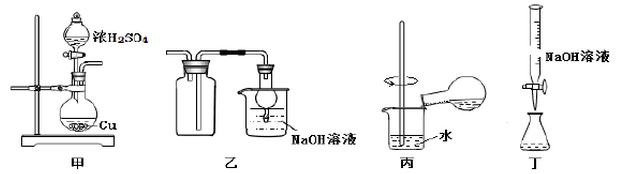
A.用装置甲进行铜和浓硫酸的反应
B.用装置乙收集二氧化硫并吸收尾气
C.用装置丙稀释反应后的混合液
D.用装置丁测定余酸的浓度
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. MgCO3可以除去MgCl2酸性溶液中的Fe3+
B. 实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸
C. 通过化学变化可以“点石成金”,即可将黏土转化成金单质
D. 2.24LNO与11.2O2充分反应所得气体中原子数目一定为0.3×6.02×1023
难度: 中等查看答案及解析
-
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
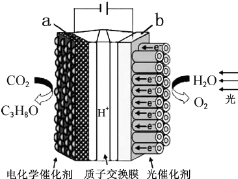
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1mol O2,有44g CO2被还原
D.a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
难度: 中等查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
A. 0.1 mol • L-1 HC1
C12
Ca(ClO)2(aq) B. Al3+
A1O2-
Al(OH)3
C. A1
NaA1O2(aq)
NaAlO2(s) D. MgO(s)
Mg(NO3)2(aq)
Mg(s)
难度: 中等查看答案及解析
-
下列关于各图象的解释或得出的结论正确的是
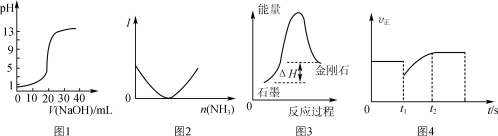
A.图1表示用0.10 mol·L-1 NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液的滴定曲线
B.图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化
C.根据图3所示可知:石墨比金刚石稳定
D.图4表示反应2SO2+O2
2SO3,t1时刻只减小了SO3的浓度
难度: 中等查看答案及解析
-
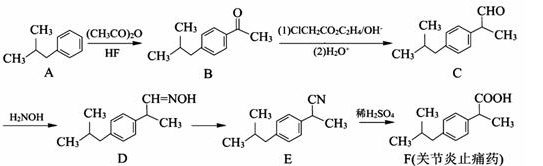
某有机物是一种医药中间体.其结构简式如图所示。下列有关该物质的说法正确的是( )
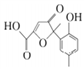
A. 该化合物分子中不含手性碳原子
B. 该化合物与NaHCO3溶液作用有CO2气体放出
C. 1 mol该化合物与足量溴水反应,消耗2 mol Br2
D. 在一定条件下,该化合物与HCHO能发生缩聚反应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 使淀粉-KI溶液变蓝的溶液:H+、 NH4+、Fe2+、Br-
B. 滴入酚酞呈红色的溶液:Na+、Ca2+、CH3COO-、Cl-
C. 滴入苯酚显紫色的溶液:Mg2+、 NH4+、Cl-、SCN-
D. 滴入甲基橙呈红色的溶液:K+、Na+、HCO3-、NO3-
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结 论
A
取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液,溶液未呈蓝色
该食盐中不含有碘酸钾
B
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色
Fe3+的氧化性大于I2
C
向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀
蛋白质均发生了变性
D
将0.1 mol·L-1,MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol • L-1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol • L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )
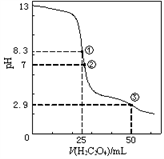
A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
难度: 中等查看答案及解析
-
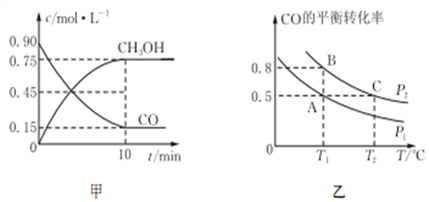
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,发生如下反应: CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g) ,测得n(CH4)随时间变化数据如下表:
温度
时间/min
0
10
20
40
50
T1
n(CH4) /mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4) /mol
0.50
0.30
0.18
……
0.15
下列说法正确的是( )
A. T2时CH4的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平 衡向正反应方向移动
D. 保持其他条件不变, T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
难度: 困难查看答案及解析