-
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径
最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式: 、 、 。
(2)写出含B元素质量分数最高的化合物的电子式: 。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式: 。
(4)用电子式表示化合物C2B的形成过程: 。
-
已知G、W、D、E、X、Y、Z是七种短周期主族元素.G是所有元素中原子半径最小的元素,元素W与元素Y位于同一主族.X、W、E三元素位于同一周期,且原子序数依次增大.D、W在周期表中的位置如表格所示.请回答下列问题.
(1)①化合物DY2 和 DW2 的分子空间构型相似,DW2的结构式为______.
②已知元素W和E的最外层电子数之和与Y和X的最外层电子数之和相差6,都由G、W、X、Y四种元素形成的两种化合物能发生反应的离子方程式为______.
③已知aX、bY、cZ三种元素,a+b+c=26,Z的最高价氧化物的水化物与其氢化物反应生成的化合物水溶液的PH______7(填“大于”、“等于”、或“小于”);如果给溶液加热,溶液的PH______(填“增大”、“等于”、或“减小”);其变化的原因是______.
(2)化合物XZ3是合成抗禽流感药物“达菲”的中间活性物质,XZ3 受撞击会生成一种非金属单质和一种离子化合物X3Z,请写出该反应的化学方程式______.若反应生成标准状况下3.36L气体单质,则电子转移的物质的量为______.
(3)化合物A、B均由上述G、W、E、X、Y五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为______,B的化学式为______.
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
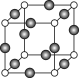
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
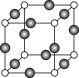
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y的最高正价与最低负价的代数和为2,W的简单阳离子半径在同周期的 主族元素中最小,Q的原子半径在同周期的主族元素中最小。下列说法正确的是( )
A.简单离子半径:Y<Z<W<Q
B.W和Q组成的二元化合物含有离子键
C.Z和W组成的二元化合物既能与强酸反应,又能与强碱反应
D.简单氢化物的沸点:Q>Z
-
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。
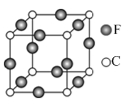
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
-
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。
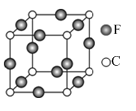
(5)C、E两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
-
(14分)短周期元素A、B、C、D、E原子序数依次增大,其中D是日常生活中常见的金属元素,E是所在周期原子半径最小的主族元素,A、B、C分别位于不同周期,且A和C同主族。回答下列问题:
(1)B和A组成的简单化合物与B元素最高价的含氧酸反应生成一种盐,则B和A组成的简单化合物的化学式为________,其空间构型为________型,属于________(填“极性”或“非极性”)分子。
(2)D原子结构示意图为________,C的晟高价氧化物对应水化物与D的最高价氧化物对应水化物反应的离子方程式为________。
(3)在B和A组成的简单化台物与BE3这两种物质中B元素的化合价相同,其中BE3可与水发生水解反应,其中会生成一种强氧化性物质,则反应方程式为________,该强氧化性物质的结构式为________。
-
位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小,B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断完成下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式___________、___________、___________、___________。
(2)C与D形成D的最低价化合物的电子式:______________________。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:____________________________________________。
-
位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式
, , , 。
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:_____ 。



