-
已知G、W、D、E、X、Y、Z是七种短周期主族元素.G是所有元素中原子半径最小的元素,元素W与元素Y位于同一主族.X、W、E三元素位于同一周期,且原子序数依次增大.D、W在周期表中的位置如表格所示.请回答下列问题.
(1)①化合物DY2 和 DW2 的分子空间构型相似,DW2的结构式为______.
②已知元素W和E的最外层电子数之和与Y和X的最外层电子数之和相差6,都由G、W、X、Y四种元素形成的两种化合物能发生反应的离子方程式为______.
③已知aX、bY、cZ三种元素,a+b+c=26,Z的最高价氧化物的水化物与其氢化物反应生成的化合物水溶液的PH______7(填“大于”、“等于”、或“小于”);如果给溶液加热,溶液的PH______(填“增大”、“等于”、或“减小”);其变化的原因是______.
(2)化合物XZ3是合成抗禽流感药物“达菲”的中间活性物质,XZ3 受撞击会生成一种非金属单质和一种离子化合物X3Z,请写出该反应的化学方程式______.若反应生成标准状况下3.36L气体单质,则电子转移的物质的量为______.
(3)化合物A、B均由上述G、W、E、X、Y五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为______,B的化学式为______.
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
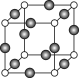
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
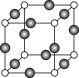
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
-
位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小,B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断完成下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式___________、___________、___________、___________。
(2)C与D形成D的最低价化合物的电子式:______________________。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:____________________________________________。
-
位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式
, , , 。
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:_____ 。
-
(本小题14分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
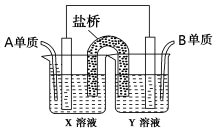
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
-
A、D、E、M、L是原子序数依次增大的五种短周期元素.已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物.回答下列问题:
(1)元素D在元素周期表中的位置是______.
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为______.
(3)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为______.(填化学式)
(4)设化合物甲、乙、丙分别为DA3EA、DA3EDA3、A2E.
ⅰ:已知:(1)丙(g)═丙(l)△H=-Q1 kJ•mol-1
(2)2甲(l)+3E2(g)═2DE2(g)+4丙(g)△H=-Q2 kJ•mol-1
Q1、Q2均大于0.若要使32g液态甲完全燃烧并恢复到室温,放出的热量为______.
ⅱ:已知:2甲(g)=乙(g)+丙(g).在某温度下,在1L密闭容器中加入甲,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol•L-1 | 0.01 | 0.2 | 0.2 |
①该温度下反应的平衡常数为______.
②10min内平均反应速率v(甲)=______.
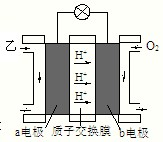
ⅲ:如图是乙为燃料的绿色电源工作原理示意图.若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:______.
-
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是________(填化学式),其原因是________;
(2)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时间后,________极(填电极名称)附近出现红色;另一极的电极反应式为________,可用检验该极所得产物。电解的总反应方程式为________。
-
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径
最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式: 、 、 。
(2)写出含B元素质量分数最高的化合物的电子式: 。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式: 。
(4)用电子式表示化合物C2B的形成过程: 。
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y的最高正价与最低负价的代数和为2,W的简单阳离子半径在同周期的 主族元素中最小,Q的原子半径在同周期的主族元素中最小。下列说法正确的是( )
A.简单离子半径:Y<Z<W<Q
B.W和Q组成的二元化合物含有离子键
C.Z和W组成的二元化合物既能与强酸反应,又能与强碱反应
D.简单氢化物的沸点:Q>Z



