-
化学是一门与社会、生活、科研密切相关的自然科学。下列有关叙述中,不正
确的是( )
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
难度: 简单查看答案及解析
-
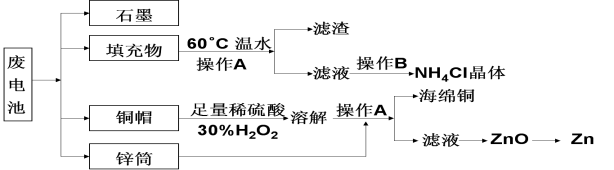
废电池伴着生活垃圾将是人类环境的新公害。下列哪种组合中的元素均是废电池中所含的有害元素( )
A.Hg、Pb、C、Na B.Cu、K、S、P
C.Hg、Pb、Mn、Ni D.Br、N、Pb、As
难度: 简单查看答案及解析
-
下列表述正确的是 ( )
A.煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生的二次能源
B.6CO2+6H2O
C6H12O
6+6O2,该变化中光能直接转变为化学能
C.CO2(g)+C(s)
2CO(g) △H>0,△S>0,该反应常温下能自发进行
D.CO2水溶液呈酸性的原因是CO2+H2O
H2CO3
2H++CO32-
难度: 简单查看答案及解析
-
利用海水资源能达到相关目标的是( )
A.用潮汐发电,将化学能转化为电能
B.不需富集,直接提取海水中的溴
C.用海水中的NaCl制取烧碱和纯碱
D.只需使海水中的碘升华就能得到碘单质
难度: 中等查看答案及解析
-
以下说法正确的是( )
A.海洋约占地球表面积的71%,所以地球上不缺水,人类可以随意使用水资源,不必节约
B.海水淡化的主要方法有蒸馏法、电渗析法、离子交换法
C.海水淡化的各种方法中,蒸馏法的成本比较低,可用于工业生产
D.污水中的重金属离子无法除去,对自然界的危害是永久的,因此要关闭重金属工业
难度: 中等查看答案及解析
-
不同的金属应选用不同的冶炼方法,如:热还原法、热分解法、电解法等。你认为选择的原则主要是依据( )
A.金属在自然界的存在形式
B.金属熔点的高低
C.金属离子得电子的能力
D.金属元素在地壳中的含量
难度: 中等查看答案及解析
-
“神舟”飞船上的太阳能帆板采用了大量先进的复合材料,以便在尽可能提高发电效能的同时,减轻其自身质量,其身价达到了上千万元。下列说法不符合事实的是( )
A.复合材料的使用可以使太阳能帆板承受超高温
B.复合材料的使用可以使“神舟”飞船质量变轻
C.复合材料的使用可以使太阳能帆板承受超高强度的改变
D.复合材料的使用可以使太阳能帆板承受温差造成的热胀冷缩的难题
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是( )
A.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
B.“天宫一号”使用的碳纤维是一种新型有机高分子材料
C.将苦卤浓缩、氧化、鼓入热空气或水蒸气提取海水中的溴
D.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅酸
难度: 中等查看答案及解析
-
氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,下列表达不正确的是( )
氨碱法
联合制碱法
A
原料
食盐、氨气、生石灰
食盐、氨气、二氧化碳
B
可能的副产物
氯化钙
氯化铵
C
循环物质
氨气、二氧化碳
氯化钠、二氧化碳
D
评价
原料易得;设备复杂;能耗高
原料利用率高;废弃物少
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.蛋白质、棉花、PVC、淀粉、涤纶都是由高分子组成的物质
B.乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者
C.雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物
D.将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念
难度: 中等查看答案及解析
-
以下反应最符合绿色化学原子经济性要求的是( )
① 乙烷与氯气制备一氯乙烷
② 乙烯聚合为聚乙烯高分子材料
③ 苯和硝酸反应制备硝基苯
④ 乙烯与氧气在银催化作用下生成环氧乙烷(C2H4O)
A. ①④ B. ①③ C. ②③ D. ②④
难度: 中等查看答案及解析
-
2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走。下列说法不正确的是( )
A.在生活舱中,可用过氧化钠制备氧气
B.金属镁可用作制造飞
机、火箭的重要材料
C.在航天试验用的仪器仪表中大量使用了硅等非金属材料
D.返回舱外层的隔热瓦使用的是金属材料
难度: 中等查看答案及解析
-
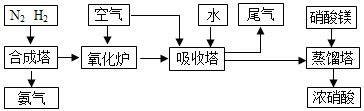
海水中含有氯化镁,是镁的主要来源之一。从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将得到的产物熔融后电解。关于提取镁,下列说法正确的是 ( )
A.此法对环境不会造成任何污染
B.沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化
C.若提取12 kg Mg,则电子转移1 000 mol
D.以上提取镁的过程涉及的离子反应共有3个
难度: 中等查看答案及解析
-
随着工业的发展,橡胶成为重要的工业原料。下列橡胶中可作为耐火橡胶的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在环境保护、资源利用等与社会可持续发展密切相关的领域化学发挥着积极作用。下列做法与此理念相违背的是:( )
A.食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期
B.“地沟油”可以制成肥皂,提高资源的利用率
C.加快开发高效洁净能源转换技术,缓解能源危机
D.“APEC蓝”是2014年新的网络词汇,形容2014年A PEC会议期间北京蓝蓝的天空。说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的
难度: 简单查看答案及解析
-
江西某铜业公司在火法炼铜时也生产硫酸。下列叙述不正确的是( )
A.自然界化合态硫以FeS2、CuFeS2等形式存在
B.火法炼铜的矿石原料主要含Cu2S
C.该公司炼铜产生的SO2可用于生产H2SO4
D.l mol/L H2SO4溶液可储存于铁制或铝制容器
难度: 中等查看答案及解析
-
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O = 3 Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O = Fe3O4+4NaOH;
下列说法不正确的是( )
A.该生产过程会产生污染
B.反应②中的氧化剂是NaNO2
C.整个反应过程中每有16.8gFe参加反应转移0.8mol电子
D.反应①②③均是氧化还原反应
难度: 困难查看答案及解析
-
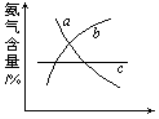
一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2-
下列说法不正确的是( )
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要
发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e﹣=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
难度: 中等查看答案及解析