-
已知化学反应A2(g)+B2(g)===2AB(g) ΔH= Q kJ·mol-1,其能量变化如图所示,则Q的值正确的是
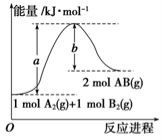
A.a-b B.a C.-b D.b-a
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) === 2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C.△H>0,△S>0,在任何温度下都不可自发进行。
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
已知热化学方程:
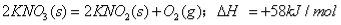
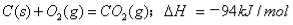
为提供分解1molKNO3所需的能量,理论上需完全燃烧碳
A.58/94mol B.58/(94×2) mol C.(58×2)/94mol D.(94×2)/58mol
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.溶液中
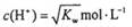 (KW为溶液所处温度时水的离子积常数)
(KW为溶液所处温度时水的离子积常数)B.pH=7的溶液
C.使石蕊试液呈紫色的溶液
D.等体积0.1 mol·L-1硫酸与0.1 mol·L-1的氢氧化钠溶液混合后的溶液
难度: 中等查看答案及解析
-
下列叙述正确的是
A.常温下,反应C(s) + CO2(g)=2CO(g)不能自发进行,则该反应△H>0
B.强电解溶液的导电能力一定强于弱电解质溶液的导电能力
C.CH3COOH、Cu(OH)2、BaSO4、NH3都是常见的弱电解质
D.常温下就能发生的化学反应一定是放热反应
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s) ΔH>0下列叙述正确的是
A.加入少量W,逆反应速率增大
B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.平衡后加入X,上述反应的ΔH增大
难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是
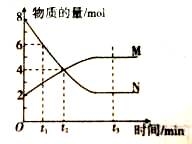
A.反应的化学方程式:2N
M
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.反应开始时只投入了N
难度: 简单查看答案及解析
-
下列图象能正确地表达可逆反应3A(g)+B(g)
2C(g)△H<0的是
A.
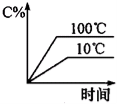
B.
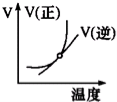
C.
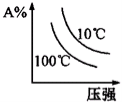
D.

难度: 困难查看答案及解析
-
1000 K时反应 C(s)+2H2(g)
CH4(g)的K=0.5,当各气体物质的量浓度分别为H2 0.7 mol·L-1、CH4 0.2 mol·L-1时,上述反应
A.正向移动 B.逆向移动 C.达到平衡 D.不一定
难度: 中等查看答案及解析
-
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)
CuS(s)+Mn2+(aq),下列说法错误的是
A.相同条件下,MnS的Ksp比CuS的Ksp大
B.该反应的平衡常数K=
C.该反应达到平衡时c(Mn2+)=c(Cu2+)
D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
难度: 中等查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是
A.常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.NaHSO3和NaHCO3的中性混合溶
液中(S和C均用R表示):C(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③
D.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液②pH=3的HCl溶液③pH=11的氨水中由水电离出的c(H+):①>③>②
难度: 困难查看答案及解析
-
下列叙述正确的是
A.SO2是电解质,其水溶液能导电
B.酸式盐的水溶液一定呈酸性
C.常温时水电离出的c(H+)=10-4 mol/L的溶液,不可能是稀盐酸
D.常温时纯水的电离平衡常数为1.0×10-14
难度: 中等查看答案及解析
-
有关常温下pH均为3的醋酸和硫酸的说法正确的是
A、两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1
B、分别加水稀释100倍后,两种溶液的pH仍相同
C、醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D、分别加入足量锌片,两种溶液生成H2的体积相同
难度: 中等查看答案及解析
-
下列说法正确的是
A.明矾水解形成的Al(0H)3胶体能杀菌消毒,可用于水的净化
B.镀锡的铁制品比镀锌的铁制品耐用
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和CH3COOH恰好中和时,消耗NaOH的物质的量相同
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,NH4+浓度最大的是
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH4HCO3
难度: 中等查看答案及解析
-
将0.2 mol/L的HX溶液和0.1mol/L的NaOH溶液等体积混合(忽视混合前后溶液体积的变化),下列关系式中一定不正确的是
A.c(HX) >c(X—)
B.c(Na+)<c(X—)
C.c(H+)+c(Na+) = c(OH—)+c(X—)
D.c(HX)+c(X—)=0.2mol/L
难度: 中等查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾[KAl(SO4)2·12H2O]溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl
D.小苏打溶液中加入少量的NaCl固体
难度: 中等查看答案及解析
-
下列关于0.2mol/LNaHCO3溶液的说法正确的是
A.溶质电离方程式为NaHCO3=Na++H++CO32-
B.25
℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
D.温度升高,c(HCO3-)增大
难度: 中等查看答案及解析
-
为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
A.②④ B.①②⑤ C.③④⑤ D.②③
难度: 中等查看答案及解析
-
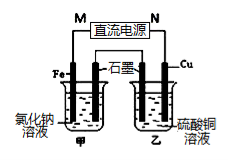
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。则A、B、C为
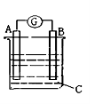
A. A是Zn,B是Cu,C是稀H2SO4
B. A是Cu,B是Zn,C是稀H2SO4
C. A是Fe,B是Ag,C是稀AgNO3溶液
D. A是Ag,B是Fe,C 是稀 AgNO3溶液
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是A.充电时阳极反应:Ni(OH)2 -e- + OH- =NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH- 向正极移动
难度: 困难查看答案及解析
-
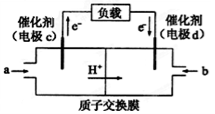
新型NaBH4 / H2O2燃料电池(DBFC)的结构如下图所示(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是
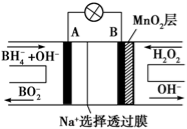
A.放电过程中,Na+从正极区向负极区迁移
B.电极B材料中含MnO2层,MnO2可增强导电性
C.电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O
D.电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个
难度: 困难查看答案及解析
-
用惰性电极电解2L、1mol/L的CuSO4溶液,在电路中通过0.5mol电子后,调换正、负极,电路中又通过了1mol电子,此时溶液中H+的浓度(假设溶液体积不变)是
A.1.5mol/L B. 0.75mol/L C. 0.5mol/L D. 0.25mol/L
难度: 中等查看答案及解析

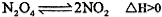
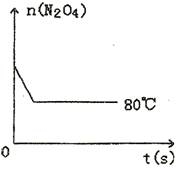

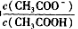 =__________。
=__________。