-
冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得。
实验步骤:
Ⅰ.如图,在100 mL三口烧瓶中放入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯,再小心地加入8 mL浓硫酸,摇动混匀:加入1~2粒沸石,装上回流冷凝管在石棉网上保持85—95℃,加热回流1.5-2小时:
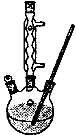
Ⅱ.待装置冷却后,分离出甲醇,向烧瓶中加入50 mL,水,然后转移至分液漏斗,分出下层产物,弃去上层水层,有机层再倒入分液漏斗中;依次用50 mL5%NaHCO3溶液洗1次(溶液呈弱碱性),30 mL水洗一次(产物皆在下层),有机层得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分。产品经0.5 g无水CaCl2干燥后称重。
常用物理常数:
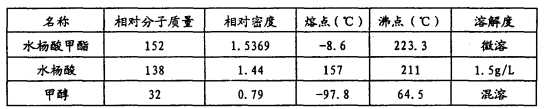
请根据以上信息回答下列问题:
(1)制备冬青油的化学方程式为______________。
(2)制备冬青油时,最合适的加热方法是_______________。实验中加入甲苯作带水剂的目的是____________________。
(3)反应结束冷却后,分离甲醇的操作是:___________________;
(4)在提纯粗产品的过程中,用碳酸氢钠溶液洗涤主要除去的杂质是____________:若
改用氢氧化钠溶液是否可以____________(填“可以”或“不可以”),其原因是________________。
(5)检验产品中是否含有水杨酸的化学方法是__________________。最终称得产品的质量为4.2 g,则所得水杨酸甲酯的产率为___________(保留两位有效数字)。
-
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
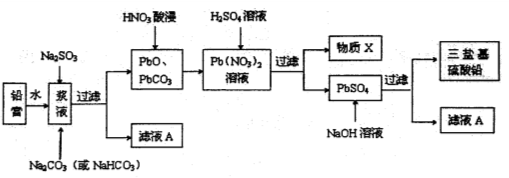
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,转化反应式如下:
PbSO4(s)+CO (aq)
(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)
①下列说法错误的是:___________________。
A.PbSO4的Ksp比PbCO3的Ksp大
B.该反应平衡时,c(CO )=c(SO42-)
)=c(SO42-)
C.该反应的平衡常数K=
②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在_________溶液中PbSO4转化率较大,理由是_________。
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是______________。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的SO过,循环利用时可能出现的问题是__________________。
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入__________mL的0.5 mol·L-1 Na2SO3溶液。
-
1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
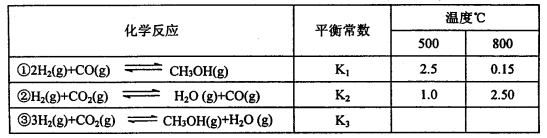
(1)反应②是____________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
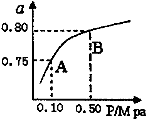
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示
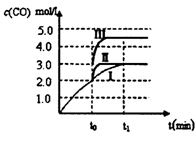
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如下图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,
以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
(5)一定条件下甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_____________。
-
溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
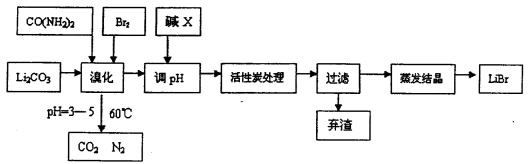
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
-
碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题:
(1)基态氟原子的核外电子排布式是______________ 。
(2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。
(3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。
(4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量:
(5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。
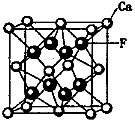
(6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的C 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C 周围距离最近且相等的Ca2+数目为__________,C
周围距离最近且相等的Ca2+数目为__________,C 与O
与O 互为等电子体,O
互为等电子体,O 的电子式为____________。
的电子式为____________。
-
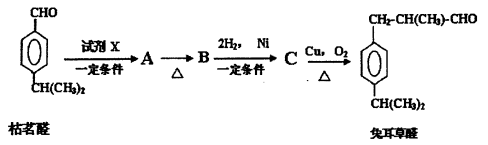
枯茗醛天然存在于枯茗油、茴香等物质中,可用来调配蔬菜、茴香等香型的食用香精。现由枯茗醛合成兔耳草醛,其传统合成路线如下:
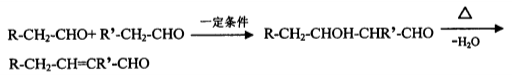
已知醛在一定条件下发生如下反应:
请回答下列问题:
(1)写出试剂X的结构简式:________________。
(2)写出有机物B的结构简式:________________;检验B中的官能团时,需先加入的试剂是____________;酸化后,再加入的试剂是_____________。
(3)写出有机物C生成兔耳草醛的化学方程式:_______________。
(4)以下是人们最新研究的兔耳草醛的合成路线,该路线原子利用率理论上可达100%:

试写出D的结构简式:______________。D→兔耳草醛的反应类型是______________。
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应;
b.核磁共振氢谱显示:Y消去反应产物的环上只存在一种化学环境的氢原子;
写出Y可能的结构简式:______________,______________。

)之和
 ,则M的结构式共有( )
,则M的结构式共有( )










