-
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
A.“洧水”的主要成分是油脂
B.“洧水”的主要成分是煤油
C.烟的主要成分是炭黑
D.烟的主要成分是石墨
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.乙烯的结构简式:CH2CH2 B.次氯酸的结构式:H – Cl-O
C.原子结构示意图:
D.NH4+ 的电子式:
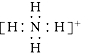
难度: 简单查看答案及解析
-
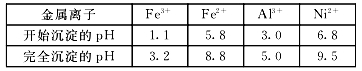
向含有c(FeCl3)=0.2 mol·L-l、c(FeCl2)=0.1 mol·L-l的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是
A.该分散系的分散质为Fe2O3
B.加入NaOH时发生的反应可能为:Fe2+ + 2Fe3+ + 8OH- = Fe3O4 + 4H2O
C.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷
D.可用过滤的方法将黑色金属氧化物与Na+分离开
难度: 中等查看答案及解析
-
下列操作中,后者最终能被漂白的是
A.将干燥的氯气与红色鲜花充分接触 B.将H2O2加入到KMnO4溶液中
C.将足量SO2通入紫色石蕊试液中 D.将漂白液加入到Fe2 (SO4)3溶液中
难度: 中等查看答案及解析
-
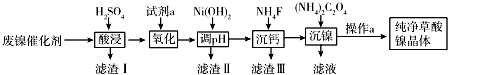
从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
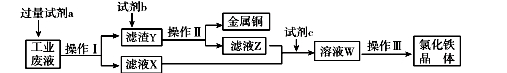
则下列说法正确的是
A.试剂a是铁、试剂b是稀硫酸
B.操作I、操作Ⅱ、操作Ⅲ所用仪器相同
C.试剂c是氯气,相应的反应为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
D.用酸性KMnO4溶液可检验溶液W中是否还有Fe2+
难度: 中等查看答案及解析
-
下列与滴定实验有关的说法中正确的是
A.用NaOH滴定盐酸时,只能用酚酞作指示剂
B.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂
C.用滴定管准确量取20.0 mL盐酸
D.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA
B.0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA
C.64 g的SO2与足量的O2充分反应后可得到NA个SO3分子
D.标准状况下,2.24 L HF含有的分子数目为0.1NA
难度: 中等查看答案及解析
-
氨基酸分子之间通过氨基与羧基间的取代反应可生成多肽与水,现有两种氨基酸间的反应为:
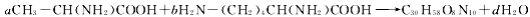 ,则a:b等于
,则a:b等于A.4:3 B.2:3 C.3:2 D.3:4
难度: 中等查看答案及解析
-
下述实验可以达到预期目的的是
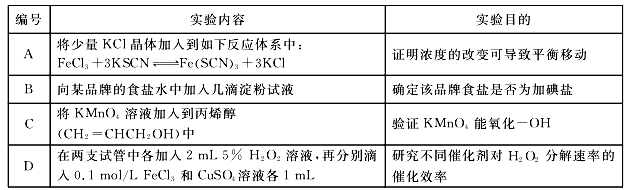
难度: 中等查看答案及解析
-
已知饱和酸(A)与足量的乙醇(B)在一定条件下生成酯(C),若M(C)=M(A)+56且A分子比B分子多3个碳原子,则上述反应生成的C最多有
A.4种 B.5种 C.6种 D.7种
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.向4 mL FeCl2溶液中滴加两滴浓硝酸: Fe2++2H++ NO3—=Fe3++NO2↑+H2O
B.向石灰水中加入过量的NaHCO3溶液: Ca2++2OH—+2HCO3—=CaCO3↓++CO32—+2H2O
C.铝与稀硫酸反应:Al +2H+=Al3+ +H2↑
D.向NH4 Al(SO4)2加入少量的NaOH溶液:NH4+ + NaOH =NH3·H2O
难度: 中等查看答案及解析
-
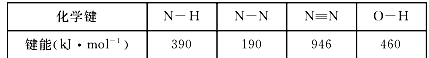
原子序数依次增大的四种短周期元素X、Y、Z、W,X与Z同主族且X最外层电子比次外层电子多2个,Y元素的周期序数等于族序数,W元素的最高正价与最低负价代数和为4,下列说法错误的是
A.最高价氧化物对应水化物的酸性:W>X>Z>Y
B.氢化物的稳定性:X>Z
C.Y单质可用于钢轨的焊接
D.原子半径大小顺序:X<Y<Z<W
难度: 中等查看答案及解析
-
已知25℃时:①HF(aq)+OH-(aq)
F-(aq)+H2O(l) ΔH=-67.7 kJ/mol
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol下列有关说法中正确的是
A.HF电离:HF(aq)
H+(aq)+F-(aq)△H=+10.4KJ/mol
B.水解消耗0.1 mol F-时,吸收的热量为6.77 kJ
C.中和热均为57.3 kJ/mol
D.含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量为6.77 kJ
难度: 中等查看答案及解析
-
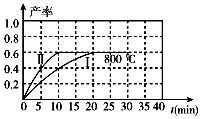
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
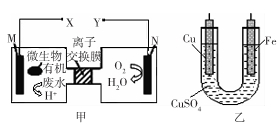
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n + 7nH2O-24ne-= 6nCO2↑ + 24nH+
D.当N电极消耗0.25 mol气体时,则铁电极增重16 g
难度: 中等查看答案及解析
-
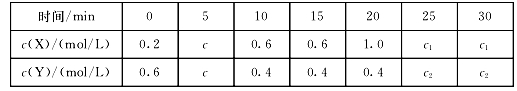
25℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是

A.实验甲所得溶液:c(Cl-)>c(M+)>c(H+)>c(MOH)
B.将实验甲中所得溶液加水稀释后,
变小
C.a>0.10
D.MOH的电离平衡常数可以表示为Kb =
难度: 困难查看答案及解析
-
已知常温下Ksp(AgCl)=1.8×l0-10,Ksp(AgBr)=5×10 -13,下列有关说法错误的是
A.在饱和AgCl、AgBr的混合溶液中:
= 360
B.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C.AgCl在水中溶解度及Ksp均比在NaCl溶液中的大
D.欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol/L
难度: 中等查看答案及解析

 ,则阳极上电极反应式为
,则阳极上电极反应式为