-
下列说法正确的是
A.H、D、T属于同位素,H2、D2、T2属于同素异形体
B.氯水、氨水、王水是混合物,铁粉、漂白粉是纯净物
C.HCl、NH3、BaSO4是电解质,CO2、Cl2、C2H5OH是非电解质
D.风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是
A.27g铝的原子最外层电子总数为NA
B.2.8 g N2和2.8 g CO所含电子数均为1.4NA
C.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
D.标准状况下,22.4L乙醇的分子数为NA
难度: 困难查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是
A.1 mol NH5中含有5 NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为
D.它与水反应的离子方程式为NH4++ H-+ H2O = NH3·H2O + H2↑
难度: 困难查看答案及解析
-
下列叙述正确的是

图A 图B 图C 图D
A.图A是将溶解好的溶液转移到容量瓶中
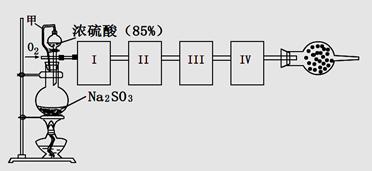
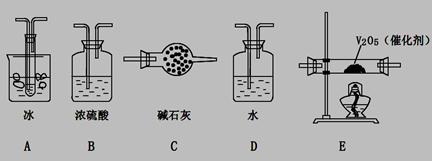
B.选择合适的试剂,用如图B所示装置可分别制取并收集少量H2、NO2和Cl2
C.图C是N2与H2合成氨的能量变化曲线,可确定该反应1 mol N2和4 mol H2充分反应时放热一定小于92 kJ
D.如图D可观察KCl的焰色反应
难度: 中等查看答案及解析
-
某学生用NaHCO3和KHCO3组成的某固体混合物进行实验,测得如下表数据(盐酸的物质的量浓度相等):
实验编号
①
②
③
盐酸体积
50mL盐酸
50mL盐酸
50mL盐酸
m(混合物)
9.2g
16.56g
27.6g
V(CO2)(标准状况)
2.24L
3.36L
3.36L
分析表中数据,下列说法不正确的是( )
A.由①可以计算出盐酸的物质的量浓度
B.由②、③可知:混合物质量增加,气体体积没有变化,说明盐酸已经反应完全
C.由①、②可知:①中的固体不足而完全反应
D.由①可以计算出混合物的NaHCO3的质量分数
难度: 困难查看答案及解析
-
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化;
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
难度: 困难查看答案及解析
-
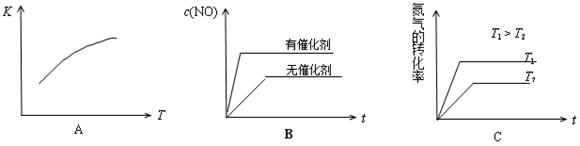
I2在KI溶液中存在下列平衡:l2(aq)+I-(aq)
I3-(aq),c(I-3)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )

A.反应I2(aq)+I-(aq)
I3-(aq)的△H<O
B.若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有
>
D.状态A与状态B相比,状态A的c(I2)大
难度: 困难查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的PH=7
C.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
D.混合溶液中,c(H+)=
难度: 困难查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说中正确的是( )
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W与Y可形成既含极性共价键又含非极性共价键的化合物
C.W、X、Y、Z原子的核外最外层电子数的总和为20
D.有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
难度: 困难查看答案及解析
-
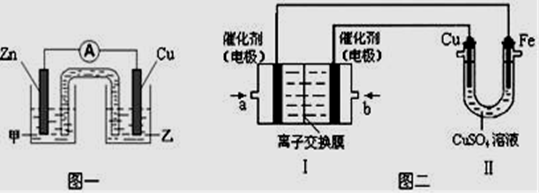
根据右图,下列判断中正确的是

A.烧杯a中的溶液pH升高 B.烧杯b中发生还原反应
C.烧杯a中发生的反应为2H++2e-=H2 D.烧杯b中发生的反应为2Cl--2e-=Cl2
难度: 中等查看答案及解析
-
CsICl2是一种碱金属的化合物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
A.Cs显 +3价,I、Cl均显 – 1价
B.Cs显 + 1价,Cl显 + 1价,I显 – 1价
C.在CsICl2溶液中通入Cl2,有单质碘生成
D.在CsICl2溶液中通入SO2气体,有硫酸生成
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2 = 4SO32―+O2↑+ 4Na+
B.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+) = 7∶2时,2Al3+ + 7OH-= Al(OH)3↓+ AlO2- + 2H2O
C.Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2) = 1∶1时,2Fe2++ 4Br-+3Cl2 =" 2" Fe3++ 2Br2 + 6Cl-
D.向次氯酸钙溶液通入过量CO2:Ca2++ 2ClO一+ CO2 + H2O = CaCO3↓+ 2HclO
难度: 困难查看答案及解析
-
向含Al2(SO4)和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加人Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
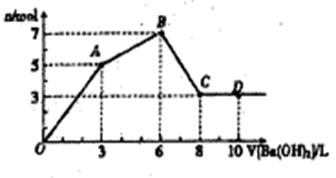
A.图中C点铝元素存在形式是AlO2-
B.向D点溶液中通人C02气体,立即产生白色沉淀.
C.原混合液中c{Al2(SO4)3} :c(AlCl3)=1:2
D.OA段反应的离子方程式为: 3Ba2+ +2Al3+ +8OH- +3SO42-=3BaSO4↓+2AlO2-+4H2O
难度: 困难查看答案及解析
-
将Fe和Fe2O3的混合物加入25mL 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积至少是( )
A.40mL B.45mL C.50Ml D.无法确定
难度: 中等查看答案及解析
-
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应: 2SO2(g)+O2(g)
2SO3(g)。达平衡时测得有关数据如下表:
容 器
甲
乙
反应物投入量
2 mol SO2、1 mol O2
4 mol SO3
n(SO3)/mol
1.6
a
反应物的转化率
α1
α2
下列说法正确的是( )
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率ν(O2)=" 0.2" mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡逆向移动
难度: 极难查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 中等查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1 C.-330kJ·mol-1 D.+330kJ·mlo-1
难度: 中等查看答案及解析
-
下列叙述正确的是
A.pH=2的醋酸加水稀释100倍后,溶液pH值等于4。
B.室温下,物质的量浓度相同的苯甲酸钠溶液比碳酸钠溶液的碱性强。
C.相同温度下,pH=2的氯化铁溶液中水的电离度比pH=1的硫酸溶液中水的电离度大。
D.pH=3的溶液与pH=11的溶液等体积混合后,溶液一定呈中性
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;
c(NH4+) 由大到小的顺序是:①>②>③>④
B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) +c(H+) =" c" (S2―) +c (HS―)+c (OH―)
D.AgCl悬浊液中存在平衡: AgCl(s)
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
难度: 极难查看答案及解析
-
CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是 ( )
A.2I--2e-=I2碘遇淀粉变蓝
B.Cu-2e-=Cu2+Cu2+显蓝色
C.2Cu+4I--4e-=2CuI↓+I2碘遇淀粉变蓝
D.4OH――4e-=2H2O+O2O2将I-氧化为I2,碘遇淀粉变蓝
难度: 困难查看答案及解析