-
从化学角度分析,下列叙述不正确的是
A.化学是以实验为基础的一门学科,定量研究方法是化学发展为一门学科的重要标志
B.铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等
C.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的净化
D.高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障。但低空的臭氧是污染气体,会给人体造成伤害
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起到重要的作用,下列分类标准合理的是
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.二氧化硅的分子式:SiO2
B.质子数为53,中子数为78的碘原子:
C.甲基的电子式:
D.邻羟基苯甲酸的结构简式:
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.0.1 mol的D37Cl分子中的中子数是2NA
B.46g乙醇所含的羟基的电子数是7NA
C.2.3gNa与足量O2反应,生成Na2O和Na2O2的混合物,钠共失去0.1NA个电子
D.18g葡萄糖分子中含有共用电子对数为2.2NA
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
在下列条件下,能大量共存的离子组是
A.c(H+)=1×10-14mol/L的溶液: K+、Cu2+、I-、SO42-
B.水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42-
难度: 中等查看答案及解析
-
下列说法正确的是
A.c(H+)>c(OH一)的溶液一定显酸性
B.常温下,pH=6的溶液一定是酸溶液
C.电解稀硫酸或氢氧化钠溶液的产物不同
D.水电解生成氢气和氧气,证明水是弱电解质
难度: 中等查看答案及解析
-
下列说法不正确的是

图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图Ⅰ所示装置可制备氢氧化亚铁
B.图Ⅱ所示装置可电解制氯气和氢气
C.图Ⅲ所示装置可验证氨气在水中的溶解性
D.图Ⅳ所示装置和操作可从苯酚中分离出苯
难度: 中等查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
序号
氧化剂
还原剂
其它反应物
氧化产物
还原产物
①
Cl2
FeBr2
/
Cl-
②
KClO3
浓盐酸
/
Cl2
③
KMnO4
H2O2
H2SO4
O2
Mn2+
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
难度: 中等查看答案及解析
-
下列物质转化在给定条件下能实现的是
①

②

③
④

⑤
A.①③⑤ B.②③④ C.②④⑤ D.①③④⑤
难度: 中等查看答案及解析
-
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO
3NaCl + NaClO4;NaClO4
NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3>Co(OH)3>I2
B.还原性(碱性溶液):Fe(OH)2>I2>KIO3
C.热稳定性:NaCl>NaClO4>NaClO
D.酸性(水溶液):HSCN>H2CO3>HCN
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是
A.小苏打溶液显碱性:HCO3-+H2O≒H2CO3+OH-
B.FeCl3溶液中滴加过量的氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
C.CuSO4溶液中滴加过量的氨水:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
D.向FeSO4溶液中加少量过氧化钠粉末:6H2O+4Na2O2+4Fe2+=4Fe(OH)3↓+O2↑+8Na+
难度: 中等查看答案及解析
-
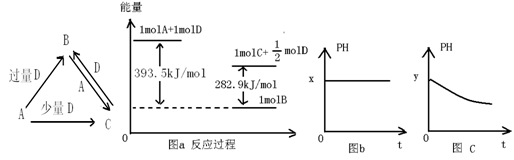
根据已知条件,对物质的性质强弱判断不正确的是
A.已知HF的共价键键能比HCl大,说明稳定性:HF>HCl
B.已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物
C.已知
+SO2+H2O→
+Na2SO3,说明给出质子能力:HSO3->苯酚
D.已知CaCO3+SiO2
CaSiO3+CO2↑,说明非金属性:碳>硅
难度: 中等查看答案及解析
-
下列说法正确的是
A.用量筒量取硝酸的体积时,俯视读数偏大
B.海带中碘元素提取时氧化滤液中的I-时应加入过量氯水
C.检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,加亚硝酸钠、AgNO3溶液和稀硝酸
D.金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠和白磷应保存在煤油中
难度: 中等查看答案及解析
-
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙。过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论不正确的是
A.铜与浓硫酸反应所得白色固体甲是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体甲中夹杂的少量黑色物质乙中可能含有CuO
D.白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S
难度: 中等查看答案及解析
-
下列叙述正确的是
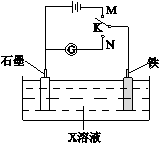
A.K与N连接时,X为硫酸,一段时间后溶液的pH增大
B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e—=H2↑
C.K与M连接时,X为硫酸,一段时间后溶液的pH增大
D.K与M连接时,X为氯化钠,石墨电极反应:4OH—-4e—=2H2O+O2↑
难度: 中等查看答案及解析
-
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
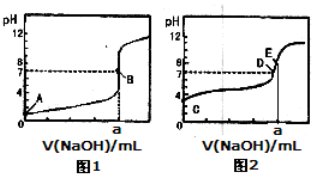
以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是

A.α和δ两种生育三烯酚互为同系物,β和γ两种生育三烯酚互为同分异构体
B.四种生育三烯酚均可使酸性高锰酸钾溶液褪色
C.四种生育三烯酚的结构中均不存在手性碳原子
D.1molα生育三烯酚最多可消耗6molH2
难度: 中等查看答案及解析
-
物质的量为0.20 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.6.4g B.8.0g C.8.4g D.9.2g
难度: 中等查看答案及解析
-
某课外小组欲测定过氧化钠与碳酸钠混合物中过氧化钠的质量分数,准确称量a克样品,下列后续实验方案中,不合理的是
A.隔绝空气加热,冷却后,称量剩余固体质量m1g
B.与足量稀盐酸反应并蒸干,称量剩余固体质量m2g
C.与足量水反应并加热,收集到标准状况下V1L干燥气体
D.与足量稀硫酸反应并加热,收集到标准状况下V2L干燥气体
难度: 中等查看答案及解析
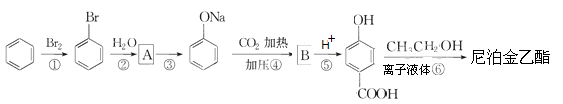
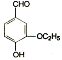 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。