-
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96 g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________,阴离子是________。
(2)试通过计算确定该结晶水合物的化学式________。
高三化学计算题中等难度题查看答案及解析
-
(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4—恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________,阴离子是________。
(2)试通过计算确定该结晶水合物的化学式。
高三化学计算题简单题查看答案及解析
-
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式 。
高三化学填空题中等难度题查看答案及解析
-
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。(填离子符号)
(2)试通过计算确定该结晶水合物的化学式。 (写出计算过程)
高三化学计算题困难题查看答案及解析
-
某结晶水合物含有两种阳离子和一种阴离子.称取质量为1.96g的该结晶水合物,配成溶液.加入足量Ba(OH)2溶液并加热该混合物,生成白色沉淀,随即沉淀变为灰绿色,最后变成红褐色,标况下产生224mL能使湿润的红色石蕊试纸变蓝的气体;将沉淀过滤、洗涤并灼烧至恒重,得到固体粉末2.73g;用足量稀盐酸处理上述粉末,洗涤和干燥后得到白色固体2.33g.
(1)该结晶水合物含有的两种阳离子是________和________,阴离子是________.写出导致白色沉淀颜色变化的反应化学方程式:________.
(2)试通过计算确定该结晶水合物的化学式________.高三化学填空题中等难度题查看答案及解析
-
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况),最后白色沉淀逐渐减少并最终消失;另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子和一种阴离子是________。
(2)试通过计算确定该结晶水合物的化学式________。
(3)写出加入过量的Ba(OH)2溶液发生的离子反应方程式:________;
(4)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol·L-1。则加入________mL Ba(OH)2溶液时,所得沉淀的总物质的量最大。
高三化学选择题中等难度题查看答案及解析
-
(每空2分,作图3分,共13分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是Al3+和________,阴离子是________。
(2)试通过计算确定:n(Al3+)=________;该结晶水合物的化学式________ 。
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol/L。
①加入 mLBa(OH)2溶液时,所得沉淀的总物质的量最大。
②请在下图中画出生成沉淀的物质的量与加入Ba(OH)2溶液体积的关系示意图。
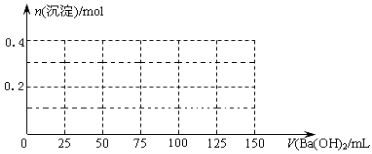
高三化学填空题中等难度题查看答案及解析
-
(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3 g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。
另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是: 和 。
(2)试通过计算确定该结晶水合物的化学式为 。
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0 mol·L-1。
①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 。
②若加入75 mL的Ba(OH)2溶液,则得到的沉淀质量为 g。
高三化学计算题中等难度题查看答案及解析
-
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3 g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,发现开始溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是: ________ 和 ________ 。
(2)试通过计算确定该结晶水合物的化学式为 ________ 。
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0 mol·L-1。
①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 ________ 。
②若加入75 mL的Ba(OH)2溶液,则得到的沉淀质量为 ________ g。
高三化学填空题中等难度题查看答案及解析
-
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。________
⑶ 假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系________
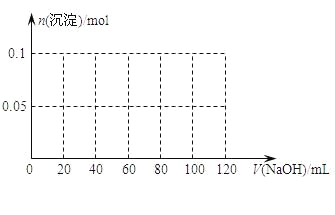
高三化学填空题简单题查看答案及解析