-
如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+ 2B(g)
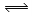 C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答: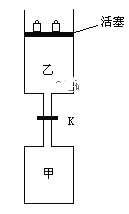
(1)乙中B的转化率为______________;
(2)甲中D和乙中C的物质的量比较:__________(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为________(用含V的代数式表示,连通管中气体体积忽略不计)。
高三化学计算题中等难度题查看答案及解析
-
I. 恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g)
 C(g)
C(g)(1)若开始时放入1mol A和1mol B,到达平衡后,生成amol C。这时A的物质的量为_____mol。
(2)若开始时放入3mol A和3mol B,到达平衡后,生成C的物质的量为____mol。
(3)若开始时放入xmol A、2mol B和1mol C,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=___mol,y=___mol。平衡时,B的物质的量________(选填一个编号)。
(甲)大于2mol (乙)等于2mol (丙)小于2mol (丁)可能大于、等于或小于2mol
II. 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始时放入1mol A和1mol B到达平衡后生成bmol C,将b与(1)小题的a进行比较,则________(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
高三化学计算题中等难度题查看答案及解析
-
标准状况下,向多份等量的NaOH固体中,分别加入一定体积的1.00mol/L (NH4)2Fe(SO4)2溶液充分反应,反应产生的NH3随(NH4)2Fe(SO4)2溶液体积的变化如图所示(假设生成的NH3全部逸出):
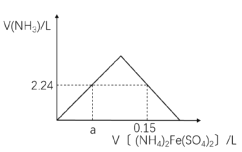
请计算:
(1)a的值为__________L。
(2)每份NaOH固体的物质的量__________mol(写出计算过程)。
高三化学计算题中等难度题查看答案及解析
-
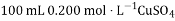 溶液与
溶液与锌粉在量热计中充分反应。测得反应前温度为
,反应后最高温度为
。
已知:反应前后,溶液的比热容均近似为
、溶液的密度均近似为
,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量
_____J。
(2)反应
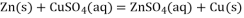 的
的______
(列式计算)。
高三化学计算题中等难度题查看答案及解析
-
由
羟基丁酸生成
丁内酯的反应如下:HOCH2CH2CH2COOH
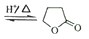 +H2O
+H2O在298K下,
羟基丁酸水溶液的初始浓度为
,测得
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
21
50
80
100
120
160
220
0.024
0.050
0.071
0.081
0.090
0.104
0.116
0.132
(1)该反应在50~80min内的平均反应速率为_____
。
(2)120min时
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数
_____。
(4)为提高
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
高三化学计算题中等难度题查看答案及解析
-
铜是人类发现最早并广泛使用的一种金属。溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+
②
+2
=
+3I-
现取某20.00mL含Cu2+的溶液。加入足量的KI充分反应后,用0.1000mo1·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液体积如表所示。
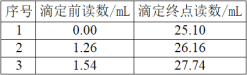
(1)溶液中Cu2+的浓度为___mol·L-1。
(2)用移液管量取20.00mLCu2+的溶液时俯视刻度线,最终测得的Cu2+的浓度将___(“偏高、偏低或无影响”)。
高三化学计算题简单题查看答案及解析
-
铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
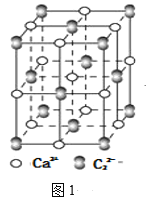
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
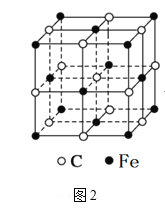
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。
高三化学计算题中等难度题查看答案及解析
-
甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应Ⅰ:CH3OH(g)
HCHO(g)+H2(g) △H1=+85.2kJ/mol
反应Ⅱ:CH3OH(g)+12O2(g)
HCHO(g)+H2O(g) △H2
反应Ⅲ:2H2(g)+O2(g)
2H2O(g) △H3=483.6kJ/mol
(1)计算反应Ⅱ的反应热△H2=___。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)=sHCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为a,则平衡时的总压强P平=___(用含P0和a的式子表示):当P0=101kPa,测得a=50.0%,计算反应平衡常数Kp=___kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
高三化学计算题中等难度题查看答案及解析
-
化学需氧量(COD)是衡量水质的重要指标之一。COD 是指在特定条件下用一种强氧化 剂(如 KMnO4)定量地氧化水体中的还原性物质所消耗的氧化剂的量(折算为氧化能力相当的O2 质量,单位:mg·L-1)。其测定过程如下: 取 100.0mL 水样,用硫酸酸化,加入 10.0 mL 0.002000mol·L-1 KMnO4溶液,充分作用后,再加入 10.0mL 0.005000mol·L-1
溶液。用 0.002000mol·L-1 KMnO4溶液滴定,滴定终点时消耗 6.50mL。
已知:2MnO
+5
+16H+=2Mn2++10CO2↑+8H2O
(1)1 mol KMnO4 的氧化能力与_____g O2 的氧化能力相当(作氧化剂时转移的电子数相同)。
(2)该水样的 COD 值是_____mg·L-1 (保留小数点后一位)。
高三化学计算题中等难度题查看答案及解析
-
将铜与Fe2O3的混合物共28.8g加入300mL2.00mol·L-1的稀硫酸中,充分反应后剩余固体的质量为6.40g。请计算:
⑴混合物加入稀硫酸中,发生反应的离子方程式为____________。
⑵混合物中铜的物质的量为____________mol。
⑶反应后的溶液中最多消耗锌片的质量为____________g。
高三化学计算题简单题查看答案及解析