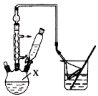
-
下列说法或表达正确的是
A.乙醇、糖类和蛋白质都是人体必需的营养物质
B.NH4I的电子式:
C.石油是混合物,其分馏产品汽油也是混合物
D.陶瓷、水晶、水泥、玻璃都属于硅酸盐
难度: 中等查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是
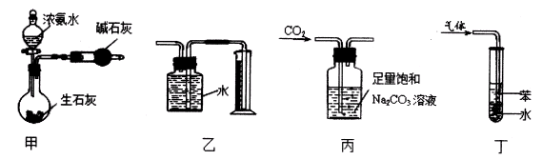
A.用甲装置制干燥的氨气
B.用乙装置收集并测量Cu与浓硝酸反应产生的气体及体积
C.用丙装置除去CO2中含有的少量HC1
D.用丁装置吸收NH3,并防止倒吸
难度: 中等查看答案及解析
-
有机物C4H8Cl2的结构中只含有一个甲基的同分异构体有几种(不考虑立体异构)
A.3 B.4 C.7 D.8
难度: 中等查看答案及解析
-
下表中对离子方程式的评价不合理的是

难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是
A.足量铁在氯气中反应,l mol铁失去的电子数为2 NA
B.标准状况下22.4 L H2中含中子数为2 NA
C.1 L Imol/L的盐酸溶液中,所含氯化氢分子数为NA
D.常温下46 g NO2和N2O4混合气体中含有原子数为3NA
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是

难度: 中等查看答案及解析
-
短周期四种元素离子W2+、X-、Y2-、Z+的电子层结构相同。下列说法正确的是
A.原子序数:W>Z>X>Y
B.离子半径:r(W2+)>r(X一)>r(Y2-)>r(Z+)
C.Y的气态氢化物比X的气态氢化物稳定
D.氢氧化物碱性强弱:W(OH)2>ZOH
难度: 中等查看答案及解析
-
【化学——选修3物质结构与性质】(15分)已知A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第四行、第十一列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是____ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中
键和
键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示)。
(4)C的气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型
有____ (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为____ ;B和E分别与氧元素形成的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为a(cm),则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
难度: 困难查看答案及解析
-
【化学——选修5有机化学基础】(15分)
乙苯是一种重要的化工原料。以乙苯为原料通过以下转化可得多种化工产品。
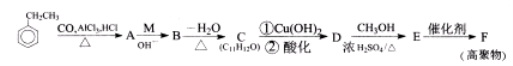
己知:
I.
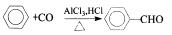
II.
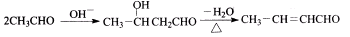
III.A中苯环上的一氯代物只有2种
(1)写出物质A的分子式 ,M的结构简式: 。
(2)C中苯环侧链所含官能团的名称是 。
(3)E→F的反应类型是 。
(4)关于B的说法正确的是 。(填选项字母)
a.能发生银镜反应
b.能发生消去反应
c.遇FeCl3溶液发生显色反应
d.能与H2发生加成反应
(5)写出D→E反应的化学方程式: 。
(6)符合下列条件的A的同分异构体有____ 种(不考虑立体异构),写出任意一种同分异构体的结构简式: 。
①苯环上有3个取代基
②遇FeCl3溶液发生显色反应
③能与溴水发生加成反应
难度: 极难查看答案及解析



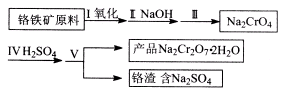
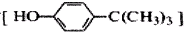 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下: