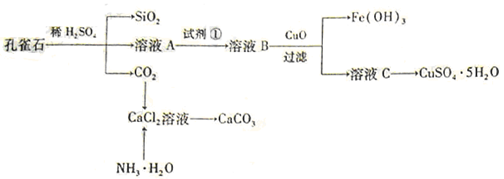
-
下列物质是非电解质的是 ( )
A.NH3 B.(NH4)2SO4 C.Cl2 D.CH3COOH
难度: 简单查看答案及解析
-
在下列反应中,水既不是氧化剂又不是还原剂的是 ( )
A.F2 + H2O (生成F2和HF) B.Na + H2O
C.NaH + H2O(生成H2和NaOH) D.Na2O2 + H2O
难度: 简单查看答案及解析
-
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
A.0.1mol B.0.5mol C.0.15mol D.0.25mol
难度: 中等查看答案及解析
-
等质量的钠进行下列实验,其中生成氢气最多的是 ( )
A.将钠投入到足量水中
B.将钠用铝箔包好并刺一些小孔,再放人足量的水中
C.将钠放入足量稀硫酸中
D.将钠放入足量稀盐酸中
难度: 简单查看答案及解析
-
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中.( )
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
难度: 中等查看答案及解析
-
某同学在实验报告中有以下实验数据:①用托盘天平称取11.7 g食盐;②用量筒量取5.26 mL盐酸;③用广泛pH试纸测得溶液的pH值是3.5,其中数据合理的是( )
A.① B.②③ C.①③ D.②
难度: 简单查看答案及解析
-
在Cu2S + 2Cu2O =6Cu + SO2↑反应中,下列说法正确的是 ( )
A.生成1molCu,转移2mol电子 B.Cu是氧化产物
C.氧化剂只有Cu2O D.Cu2S既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是 ( )
A.①②③④ B.③①②④ C.④②①③ D.③②①④
难度: 中等查看答案及解析
-
“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是 ( )
A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
B.制CuSO4:2Cu + O2 = 2CuO; Cu + H2SO4 (稀) =CuSO4 + H2O
C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2 H2O
D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4 H2O
难度: 中等查看答案及解析
-
下列叙述中,正确的是 ( )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
难度: 中等查看答案及解析
-
下列推断正确的是
A.
是酸性氧化物,能与NaOH溶液反应
B.
组成元素相同,与
反应产物也相同
C.CO、NO、
都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 简单查看答案及解析
-
向100 mL 18 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量为( )
A.小于0.90 mol B.等于0.90 mol
C.在0.90 mol和1.8 mol之间 D.1.8 mol
难度: 中等查看答案及解析
-
在无色强酸性溶液中,下列各组离子能够大量共存的是 ( )
A.Cl-、Na+、NO3-、Ca2+ B.
、HCO3-、Cl-、K+
C.K+、Ba2+、Cl -、SO42- D.Cu2+、
、I-、Cl-
难度: 中等查看答案及解析
-
下列有关物质的性质比较,不正确的是( )
A.熔点:Li>Cs B.还原性:F->I-
C.热稳定性:H2O>H2S D.酸性:H3PO4>H3AsO4
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是 ( )
A.1mol Na加热时与O2反应失去的电子数目为NA
B.92g N2O4和92g NO2含有的原子数均为6NA
C.1L 0.1mol·L-1的盐酸中,所含HCl分子数为0.1NA
D.标准状况下,22.4L O3中含3NA个氧原子
难度: 中等查看答案及解析
-
下列物质能通过化合反应直接制得的是( )
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.①②③ B.只有②③ C.只有①③④ D.全部
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
难度: 中等查看答案及解析
-
对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH< Mg(OH)2< Al(OH)3
B.第一电离能:Na< Mg <Al
C.电负性:Na> Mg >Al
D.还原性:Na> Mg >Al
难度: 中等查看答案及解析
-
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是( )
A.分子中N—C1键键长比CCl4分子中C—C1键键长长
B.分子中的所有原于均达到8电子稳定结构
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
若不断地升高温度,实现"雪花→水→水蒸气→氧气和氢气"的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是( )
A.氢键;分子间作用力;非极性键 B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力 D.分子间作用力;氢键;非极性键
难度: 中等查看答案及解析