-
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述信息,下列说法不正确的是( )
A.CaO2的水解产物是Ca(OH)2和H2O2
B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO
D.Mg3N2的水解产物是两种碱性物质难度: 中等查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N后<N前难度: 中等查看答案及解析
-
要求设计实验证明:某种盐的水解是吸热的.有四位同学作了如下回答,其中不正确的是( )
A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含有Fe3+的盐的水解是吸热的
C.丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的难度: 中等查看答案及解析
-
下列叙述中,错误的是( )
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离难度: 中等查看答案及解析
-
下列溶液中,常温下水电离的[H+]大于10-7mol/L的是( )
A.NH4Cl
B.NH3•H2O
C.HAc
D.NaHSO4难度: 中等查看答案及解析
-
下列溶液均是50ml,若分别向其中加入0.5mol/L盐酸,溶液导电性明显增强的是( )
A.0.5mol/L的H2SO4
B.0.5mol/L的NaOH
C.0.5mol/L的NH3•H2O
D.0.5mol/L的AgNO3难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.
B.
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量难度: 中等查看答案及解析
-
在pH=0的溶液中能大量共存,并且溶液为无色透明的是( )
A.K+、ClO-、Na+、NO3-
B.NH4+、Al3+、SO42-、NO3-
C.K+、MnO4-、Cl-、SO42-
D.Na+、NO3-、HSO3-、K+难度: 中等查看答案及解析
-
按图a中装置进行实验,图中两电极均为银棒,若图b的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是( )
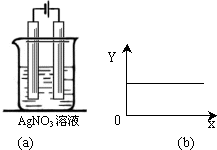
A.c(Ag+)
B.c(NO3-)
C.溶液的pH
D.银棒质量难度: 中等查看答案及解析
-
关于原电池的说法,正确的是( )
A.在正极上发生氧化反应
B.某电极上有氢气产生,则此电极为正极
C.在外电路上电子流出的为正极
D.在负极上发生还原反应难度: 中等查看答案及解析
-
关于氯化铁水解的说法错误的是:( )
A.不饱和时,无论加氯化铁饱和溶液还是加水稀释,水解平衡均正向移动
B.其他条件相同时,越浓的氯化铁溶液Fe3+的水解程度越小
C.同浓度的FeCl3溶液,其他条件相同时,高温时Fe3+的水解程度较低温时小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸难度: 中等查看答案及解析
-
已知甲、乙、丙、丁四种溶液分别为CH3COONa、NH3•H2O、CH3COOH、Na2SO4中的一种,相同温度下,甲与乙两种溶液的pH相同,甲与丙两种溶液中的水的电离程度相同,则丙为( )
A.NH3•H2O
B.CH3COONa
C.CH3COOH
D.Na2SO4难度: 中等查看答案及解析
-
能说明醋酸是弱电解质的是( )
①醋酸溶液中加入醋酸钠固体pH变大
②0.1mol•L-1的醋酸钠溶液的pH约为9
③可以用食醋清除热水瓶内的水垢
④pH=2的醋酸溶液稀释1000倍后pH小于5.
A.①③④
B.①②④
C.②④
D.①②③④难度: 中等查看答案及解析
-
酸碱指示剂一般是有机弱酸(用Hln表示)或弱碱,其分子形式与电离出的ln-形式颜色不同,在pH值不同的溶液中之所以能表现出不同的颜色,是因为其电离平衡发生移动的结果.甲基橙是一种常用的酸碱指示剂,溶于水后发生如下电离:Hln⇌H++ln-,已知在pH<3.1的溶液中呈红色,在pH>4.4的溶液中呈黄色,下列判断中不正确的是( )
A.Hln呈红色
B.ln-呈黄色
C.遇pH值介于3.1~4.4的溶液可能呈橙色
D.Hln呈黄色难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.少量的SO2通入Ca(ClO)2溶液:Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO
B.Cl2与冷水反应:Cl2+H2O⇌Cl-+ClO-+2H+
C.NaHCO3溶液与过量澄清石灰水反应:HCO3-+Ca2++OH-→CaCO3↓+H2O
D.碳酸钙溶于醋酸:CaCO3+2H+→Ca2++CO2↑+H2O难度: 中等查看答案及解析
-
常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
A.V(酸)=102V(碱)
B.V(碱)=102V(酸)
C.V(酸)=2V(碱)
D.V(碱)=2V(酸)难度: 中等查看答案及解析
-
9.2g金属钠投入到足量的H2O中,则产生的气体中含有( )
A.0.2mol中子
B.0.4mol电子
C.0.2mol质子
D.0.4mol分子难度: 中等查看答案及解析
-
下列物质露置于空气中,由于发生氧化还原反应而质量增加的是( )
A.Na
B.Na2O2
C.NaOH
D.Na2CO3•10H2O难度: 中等查看答案及解析
-
在0.1mol/LNa2S的溶液中,下列关系不正确的是( )
A.[H2S]+[HS-]+[S2-]=0.1 mol/L
B.[Na+]+[H+]=2[S2-]+[HS-]+[OH-]
C.[OH-]=[H+]+[HS-]+2[H2S]
D.2[Na+]=[S2-]+[HS-]+[H2S]难度: 中等查看答案及解析
-
将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合溶液中[Na+]>[X-],则下列关系错误的是( )
A.[OH-]<[H+]
B.[HX]<[X-]
C.[X-]+[HX]=2[Na+]
D.[HX]+[H+]=[Na+]+[OH-]难度: 中等查看答案及解析
-
镁粉与一定量盐酸反应时,速率太快,为了减缓反应速率又不影响产生氢气的总量,可以加入的物质是( )
A.H2O
B.Na2CO3
C.NaOH
D.CH3COONa难度: 中等查看答案及解析
-
常温下将pH=2的HCl溶液V1 mL与pH=a的氨水V2 mL混合.下列说法正确的是( )
A.若a=12,混合后溶液pH>7,则V2一定大于V1
B.若a=12,混合后溶液pH=7,则混合溶液V总>2V2
C.若V1=V2,且HCl与氨水恰好完全反应,则a<12
D.若V1=V2,且a=12,则混合溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)难度: 中等查看答案及解析