-
用沉淀滴定法快速测定NaI等碘化物溶液中c(I−),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L−1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L−1 AgNO3溶液(过量),使I−完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L−1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号
1
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有_________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是________________________。
(3)滴定应在pH<0.5的条件下进行,其原因是________________________________。
(4)b和c两步操作是否可以颠倒________________,说明理由___________________。
(5)所消耗的NH4SCN标准溶液平均体积为_____mL,测得c(I-)=_______________mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为____________________。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_______________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____________________。
难度: 困难查看答案及解析
-
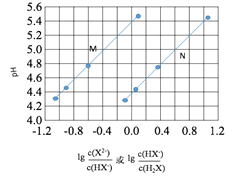
25℃时,有关物质的电离平衡常数如下:
化学式
CH3COOH
H2CO3
H2SO3
电离平衡常数
K=1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=1.5×10-2
K2=1.02×10-7
(1) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(2) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为__________。
(3) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(4) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。
难度: 中等查看答案及解析
-
A、B、C、D、E均为易溶于水的化合物,其离子组成如下表。(各化合物中离子组成不重复)
阳离子
Na+、Al3+、Ag+、Ba2+、Fe3+
阴离子
Cl-、CO32-、SO42-、NO3-、OH-
分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1 molL B溶液pH>13;
②D溶液加入铜粉,溶液质量增加;
③在E溶液中逐滴滴入B至过量,先生成白色沉淀,后沉淀完全溶解;
④在A溶液中逐滴滴入氨水至过量,先生成白色沉淀,后沉淀完全溶解。
请回答下列问题:
(1)B的名称;_______________,E的名称;______________。
(2)C水溶液呈碱性原因:_____________(用离子方程式表示);0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,阴离子的总数:C溶液___________NaHCO3溶液。(填“>”或 “<”)
(3)D溶液呈________(填“酸性”“碱性”或“中性”)。若将D溶液加热蒸干得到固体应是__________(填化学式)。若将E溶液加热蒸干后再高温灼烧得到固体应是___________ (填化学式)。
难度: 简单查看答案及解析
-
(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
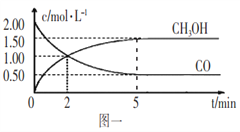
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
难度: 中等查看答案及解析