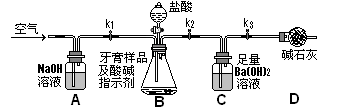
-
下列做法中用到物质氧化性的是( )
A.明矾净化水 B.纯碱除去油污
C.臭氧消毒餐具 D.食醋清洗水垢
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
A.Y(Fe2O3)—→w(Al2O3); B. Y(FeCl3)—→ w(CuCl2);
C.Y(SiO2)—→w(CO); D.Y(AgNO3)—→w [ Cu(NO3)2 ];
难度: 中等查看答案及解析
-
下列五种有色溶液通入SO2时均能褪色或变色,其实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③滴有酚酞的NaOH溶液
④溴水 ⑤石蕊溶液; ⑥FeCl3溶液
A.①④ B.①③ C.①②⑤ D.②④⑥
难度: 中等查看答案及解析
-
下列实验方法、或除去杂质的方法正确的是( )
A.钠也可以保存在CCl4中 B.钠着火时可以砂土来扑灭;
C.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是( )
A.反应5I—+IO3—+6H+ = 3I2 +3H2O生成3mol碘单质转移电子数为5NA
B.1 mol Na2O2溶于水作用时转移的电子数为2NA
C.在标准状况下,含NA个氦原子的氦气所含的分子数是0.5 NA
D.在7.8 g Na2O2晶体中阳离子与阴离子总数为0.4 NA
难度: 中等查看答案及解析
-
根据右图,可判断出下列离子方程式中错误的是( )
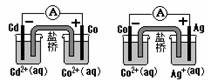
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Cd (s)+Co2+(aq)=Cd2+(aq)+Co(s)
C.2Ag+ (aq)+Cd(s)=2Ag(s)+Cd(aq)
D.2Ag+ (aq)+Co(s)=2Ag(s)+Co(aq)
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①澄清石灰水中通过量的CO2; ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水; ④向硅酸钠溶液中逐滴加入过量的盐酸
A.②④ B.①③ C.③④ D.④
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—;
B.铁的吸氧腐蚀正极电极反应: O2+4e—+ 2H2O = 4OH—
C.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4—+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
难度: 中等查看答案及解析
-
化学用语是学习化学的工具和基础。 下列有关化学用语的使用正确的是( )
A.纯碱溶液呈碱性的原因可表示为:CO32- + 2H2O
H2CO3 + 2OH-
B.氯的原子结构示意图为:
C.草酸使酸性KMnO4溶液褪色,其离子方程式为:
5C2O4 2- + 2MnO4- + 4H2O = 2Mn2+ + 10CO2↑ + 8OH—;
D.氯分子的电子式:
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 饱和氯水中 Cl-、NO3-、Na+、SO32-
B.甲基橙呈红色的溶液 NH4+、Ba2+、AlO2-、Cl-
C. c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
D.与铝反应产生大量氢气的溶液 Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。
下列有关离子反应或离子方程式的叙述中,正确的是( )
A.能使PH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
B.向溴水中加入足量氯化亚铁溶液能使溶液变成无色
C.向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+ H2O 2HClO+CO32-
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
NaCl是一种化工原料,可以制备一系列物质(见右图)。下列说法正确的是( )

A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.如图所示转化反应都是氧化还原反应
难度: 中等查看答案及解析
-
按下图装置持续不断通入X气体,并在管口P处点燃,观察到竖直试管中经历澄清石灰水变浑浊。则X、Y不可能的是( )

A.H2和NaHCO3(白) B.CO2和Na2O2(黄);
C.CO和Cu2(OH)2CO3(绿) D.CO和Fe2O3(红);
难度: 中等查看答案及解析
-
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )

A.偏铝酸钠、氢氧化钡、硫酸
B.氯化铝、氯化镁、氢氧化钠
C.氯化铝、氯化铁、氢氧化钠
D.偏铝酸钠、氯化钡、硫酸
难度: 中等查看答案及解析
-
下列实验现象预测正确的是( )

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
难度: 中等查看答案及解析