-
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
A.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
B.海轮外壳上镶入铅块,可减缓船体的腐蚀速率
C.大力开发和应用氢能源有利于实现“低碳经济”
D.高温能杀死H1Nl流感病毒的原因是蛋白质受热变性
难度: 简单查看答案及解析
-
下列化学用语或模型表示正确的是
A.Cl-离子的结构示意图:
B.乙醇分子比例模型:
C.次氯酸的结构式:H—O—Cl D.氢氧化钠的电子式:
难度: 简单查看答案及解析
-
下列物质形成的晶体中,其中任何一个原子都被相邻四个原子包围,以共价健形成正四面体,并向空间伸展成网状结构的是
A.四氯化碳 B.白磷 C.金刚石 D.水晶
难度: 简单查看答案及解析
-
下列说法不正确的是
A.向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失
B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解
C.向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解
D.向FeCl2溶液中滴加NaOH溶液,产生白色沉淀,沉淀逐渐变为灰绿色,红褐色。
难度: 简单查看答案及解析
-
下列实验或操作能达到预期目的的是
①用溴水鉴别苯、乙醇、溴苯
②用盐酸酸化的硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④将碘水倒入分液漏斗,加入CCl4,振荡后静置,可将碘萃取到CCl4中
⑤在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
A.①②③ B.①③④ C.②③④ D.②④⑤
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑
B.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓
C.向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.用石墨作电极电解CuCl2溶液:2C1-+2H2O
Cl2↑+H2↑+2OH-
难度: 简单查看答案及解析
-
2008奥运吉祥物福娃,其外材为纯羊毛线,内充物为无毒的聚酯纤维(如图)。下列说法正确的是
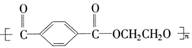
A.羊毛与聚酯纤维的化学成分相同
B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维的单体为对苯二甲酸和乙醇
D.聚酯纤维属于纯净物
难度: 简单查看答案及解析
-
下列关于电解质的叙述,正确的是
A.Cl2的水溶液能导电,但Cl2的是非电解质
B.0.1mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质
C.向pH=12的NaOH溶液通电一段时间溶液的pH>12
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
难度: 简单查看答案及解析
-
下列叙述正确的是
A.用稀NaOH清洗沾到皮肤上的苯酚
B.Na2CO3溶液保存在带玻璃塞的试剂瓶中
C.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
D.用冷凝的方法从氨气、氮气和氢气的混合气体中分离出氨气
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是
A.在含有4mol Si—O键的石英晶体中,氧原子的数目为2NA
B.常温常压下,2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA
C.标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4
D.0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2 NA
难度: 简单查看答案及解析
-
下列各条件下可能共存的离子组是
A.某无色溶液中:NH
、Na+、Cl-、MnO
B.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+
C.在c(H+)=1×10-13mol·L-1的溶液中:NH
、Al3+、SO
、CO
D.在加入Al能放出大量H2的溶液中:NH4+ 、SO42¯ 、C1¯、Na+
难度: 简单查看答案及解析
-
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A.X单质可以通过铝热法获得 B.Y的氧化物是良好的半导体材料
C.Z的氢化物比W的氢化物更稳定
D.X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
难度: 简单查看答案及解析
-
下列实验中,有关仪器的下端必须插入液面以下的是
①制备乙烯时用的温度计;②制备氯气装置中的分液漏斗;③制取氨水时氨气溶于水的导管;④制备氢气的简易装置中加入稀硫酸用的长颈漏斗;⑤分馏石油时的温度计;⑥制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管。
A.①②④ B.①④ C.①②③⑥ D.①②③④
难度: 简单查看答案及解析
-
下列说法正确的是
A.苯乙烯分子中所有原子可能在一个平面上
B.分子式为
且分子中有苯环的有机物共有4种
C.甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液
D.除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液
难度: 简单查看答案及解析
-
某有机物含有C、H、O三种元素,其球棍模型如图所示。该有机物可能发生的反应有① 水解 ② 加聚 ③ 取代 ④ 消去 ⑤ 银镜
A.①②③④⑤ B.①③④⑤
C.①③④ D.①④⑤
难度: 简单查看答案及解析
-
有机物A、B只可能是烃和烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数)
A.8n B.14n C.18n D.44n
难度: 简单查看答案及解析
-
在同温同压下,下列各组热化学方程式中Q2>Q1的是
A.H2(g)+Cl2(g)=2HCl(g);△H = -Q1 1/2H2(g)+1/2Cl2(g)=HCl(g);△H = -Q2
B.C(s)+1/2O2(g)=CO (g);△H = -Q1 C(s)+O2(g)=CO2 (g);△H = -Q2
C.2H2(g)+O2(g)=2H2O(l);△H = -Q1 2H2(g)+O2(g)=2H2O(g);△H = -Q2
D.S(g)+O2(g)=SO2 (g);△H = -Q1 S(s)+O2(g)=SO2 (g);△H = -Q2
难度: 简单查看答案及解析
-
下图所示各装置的叙述中,正确的是
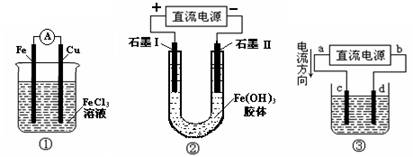
A.装置①是原电池,总反应是:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3+ + e- = Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
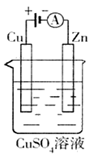
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
难度: 简单查看答案及解析
-
用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液。一段时间后,溶液颜色变浅。此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度应向电解后的溶液中加入适量的
A.Na2SO4和CuSO4 B.CuO C.Na2O和CuO D.H2O和CuSO4
难度: 简单查看答案及解析
-
已知反应N2(g)+3H2(g)
2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1∶3充入N2和H2,在一定条件下发生反应,下图是某物理量Y随时间(t)变化的示意图(图中T表示温度),Y不可以是
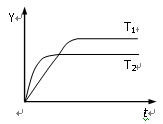
A.混合气体的密度
B.混合气中氨的体积分数
C.N2的转化率
D.混合气体的平均摩尔质量
难度: 简单查看答案及解析
-
1 L某溶液中含有的离子如下表:
离子
物质的量浓度(mol/L)
1
1
a
1
用惰性电极电解该溶液,当电路中有3 mol
通过时(忽略电解时溶液体积的变化及电
极产物可能存在的溶解现象),下列说法正确的是
A.电解后溶液的pH=0 B.a=3
C.阳极生成1.5 mol
D.阴极析出的金属是铜与铝
难度: 简单查看答案及解析
-
一定质量的铁和铜的混合物,与一定浓度的硝酸反应后溶器中没有固体剩余,生成标准状况下的2.24LNO和4.48 LNO2 (不考虑N2O2的存在)的混合气体,则参加反应的HNO3的物质的量是
A.0.5mol B.0.8mol C.1.0mol D.1.6mol
难度: 简单查看答案及解析
-
如图所示,将纯Fe棒和石墨棒插入1 L 饱和NaCl溶液中。下列说法正确的是
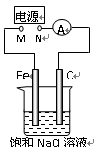
A.去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡
B.M连接电源正极,N连接电源负极,则Fe棒被保护不会溶解
C.M连接电源负极,N连接电源正极,当两极产生气体总量为22.4 mL(标准状况)时,则生成0.001 mol NaOH
D.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
难度: 简单查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构类似过氧化氢如右下图所示(如展开的书页)。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
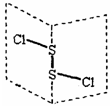
A.S2Cl2的结构式为Cl-S=S-Cl
B.S2Cl2为含有极性键和非极性键的极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
难度: 简单查看答案及解析
-
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如下图,则原混合溶液中MgCl2与FeCl3的物质的量之比为
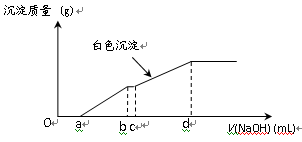
A.
B.
C.
D.
难度: 简单查看答案及解析