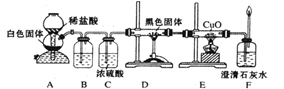
-
2011年3月11日日本宫城发生9.0级大地震并引起海啸和核泄露,当地环境受到严重污染.下列有关说法正确的是
A.海啸水退后可用漂白粉、84消毒液、ClO2的稀溶液进行消毒
B.海啸使水源发生污染也可用明矾进行消毒和净化
C.核反应属于化学反应
D.生物质能的缺点是严重污染环境
难度: 中等查看答案及解析
-
下列说法正确的是
A.聚乙烯可使酸性高锰酸钾溶液褪色
B.在检测汽车司机是否酒后驾车的仪器中,乙醇与橙色的酸性重铬酸钾溶液所发生的反应类型为还原反应
C.乙酸与乙醇的酯化反应中是乙酸中羧基氢与乙醇中羟基结合生成水
D.C3H8的二氯代物有4种
难度: 中等查看答案及解析
-
据央视《每周质量报告》3·15节目《“健美猪”真相》报道,河南孟州等地养猪场采用违禁动物药品“瘦肉精”饲养.“瘦肉精”之一盐酸克伦特罗在全世界养猪业中的使用都是违法的,最近美国FDA批准的盐酸莱克多巴胺(另一种瘦肉精)在猪中使用后,美国养猪户在使用前后有“黑夜与白天的差别”.莱克多巴胺其结构简式如下图.以下叙述中不正确的是
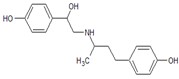
A. C18H23NO3
B. 莱克多巴属于芳香族化合物
C. 每摩尔莱克多巴胺能与3molNaOH反应
D. 莱克多巴胺可燃, 燃烧时会产生有毒氮氧化物气体
难度: 中等查看答案及解析
-
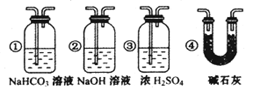
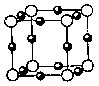
关于下列各实验装置的叙述中,不正确的是
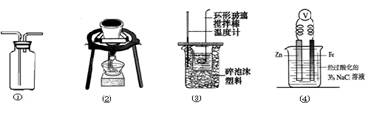
A.装置①可用于收集H2、NH3、CO2、Cl2、HC1、NO2等气体
B.装置②可用于钾在空气中的燃烧
C.装置③可用于中和反应反应热的测定
D.装置④可用于验证牺牲阳极的阴极保护法实验
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是:
A.AgNO3溶液中滴入少量的NaHS溶液:2Ag++S2-=Ag2S↓
B.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ =2 H2O + I2
C.用铜做阳极电解氯化铜溶液:Cu2++2Cl-
Cu+Cl2↑
D.硫酸铝溶液与纯碱溶液混合:2Al3++3CO32-=2Al(OH)3↓+3CO2↑
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系或计算正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有:C(NaOH)<C(CH3COONa)<C(NaHCO3)
B. 室温下,0.1 mol·L-1 NaHA溶液的PH =4,则C(HA-)>C(H+)>C(H2A)>C(A2ˉ)
C.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,C (Ag+ )最大可达到1.8×10-9 mol·L-1
D. 25℃时,0.1 mol·L-1 Na2CO3溶液中水电离出来的C(OH-)大于0.1 mol·L-1 NaOH溶液中,水电离出来的C(OH-)
难度: 中等查看答案及解析
-
在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,再加入50 mL 0.5 mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:
“________FeSO4 +________KNO3 + ________H2SO4= ________K2SO4 +________Fe2(SO4)3+________Nx Oy + ________H2O”,则对该反应的下列说法正确的是
A.反应中还原产物是NO
B.氧化产物和还原产物的物质的量之比为1:4
C.反应过程中转移的电子数为8e-
D.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
难度: 中等查看答案及解析
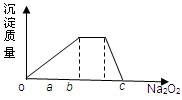
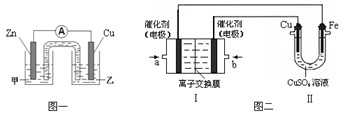
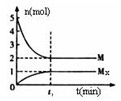
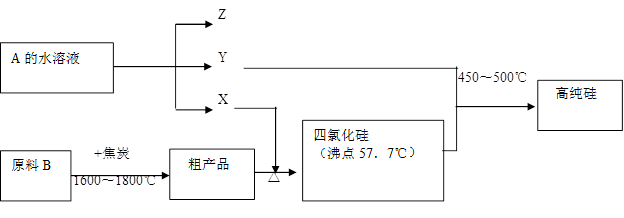

 ;
;