-
战国所著《周礼》中记载沿海古人“谋饼烧蛎房成灰”(“ 蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第—步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是
A. CaO B. Ca(OH)2 C. SiO2 D. Al2O3
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是( )
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
难度: 中等查看答案及解析
-
某有机化合物的结构简式如图所示,下列说法正确的是( )
A. 不能发生银镜发应,能发生水解反应
B. 1mol 该物质最多可与含2mol溴单质的浓溴水反应
C. 1mol 该物质最多可与4mol NaOH反应
D. 与Na、NaHCO3、Na2CO3均能发生反应
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA
B. 1L0.1 mol·L-1碳酸钠溶液中含有的氧原子数为0.3NA
C. 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
D. 0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA
难度: 困难查看答案及解析
-
某溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、Fe2+、NO3-、Cl-、SO42-中若干种组成,现将溶液分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成。则溶液中一定含有的离子有( )
A. Ag+、Al3+、NO3- B. Ba2+、Al3+、Cl-
C. Ba2+、Al3+、NO3- D. Al3+、NO3-
难度: 困难查看答案及解析
-
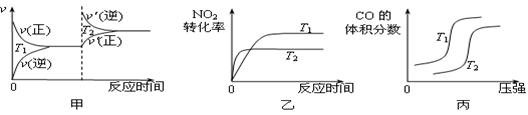
电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液滴定10.00mL浓度均为0.100mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如下图所示。
下列说法不正确的是( )
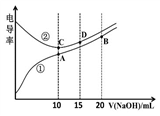
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1
C. 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-) >c(H+)
难度: 困难查看答案及解析
-
下列实验操作和现象对应的结论正确的是( )
选项
实验操作和现象
结 论
A
向溶液X中滴加BaCl2溶液,有白色沉淀生成
溶液X中可能含有SO42-
B
2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热
检验葡萄糖中含有醛基
C
向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色
Ksp (AgCl)
D
将Al2(SO4)3溶液蒸干、灼烧至恒重
最终剩余固体是Al2O3
A. A B. B C. C D. D
难度: 困难查看答案及解析