-
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
A.家中发生天然气泄漏,不能在室内用电话报警
B.明矾既可用于净水,又可杀菌消毒
C.双氧水可用于杀菌、消毒、漂白
D.洁厕剂和漂白精不能混合使用,否则易产生有毒气体
难度: 简单查看答案及解析
-
科学家用计算机模拟后确认,60个N原子可结合成N60分子.下列关于N60的叙述中正确的是
A.N60是一种新型化合物 B.N60和N2性质完全相同
C.一个N60分子中有30个N2分子 D.N60和N2混合形成的是混合物
难度: 简单查看答案及解析
-
下列说法正确的是
A.胆矾是纯净物,属于强电解质 B.非金属氧化物一定是酸性氧化物
C.含金属元素的离子一定都是阳离子 D.阳离子只有氧化性
难度: 简单查看答案及解析
-
下列有关操作和判断正确的是
A.配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高
B.用托盘天平称取25.20gNaCl
C.用100mL的量筒量取5.2mL的盐酸
D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
难度: 中等查看答案及解析
-
铍及其化合物的性质与铝十分相似,下列关于铍及其化合物的推断正确的是
A.铍能与强酸、强碱溶液发生反应 B.氢氧化铍可溶于水
C.氯化铍溶液显中性 D.氧化铍的化学式Be2O3
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A.FeO溶于稀硝酸中:FeO+2H+ = Fe2++H2O
B.过量氨水加入AlCl3溶液中:Al3++3OH¯= Al(OH)3↓
C.金属钠溶于水中:Na+H2O = Na++OH¯+H2↑
D.过量CO2通入NaOH溶液中:OH¯+CO2 = HCO3¯
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.HClO是弱酸,所以NaClO是弱电解质 B.水泥、玻璃、水晶属于硅酸盐材料
C.Na2O2的热稳定性大于NaHCO3 D.金属钠着火时可用泡沫灭火器灭火
难度: 简单查看答案及解析
-
下列除杂方法不合理的是
A.通过饱和食盐水除去Cl2中的HCl B.通过NaOH溶液除去CO2中的HCl
C.通过加热法除去Na2CO3固体中的NaHCO3 D.通过NaOH溶液除去CO中混有的CO2
难度: 简单查看答案及解析
-
美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.与H2O反应生成2.24 LH2(标况下),转移的电子为0.2 mol
C.氢铝化合物中氢显-1价
D.氢铝化合物具有强还原性
难度: 中等查看答案及解析
-
下列各项操作中不发生先沉淀后溶解现象的是
A.向饱和Na2CO3溶液中通入过量CO2
B.向Fe(OH)3胶体中逐滴滴加入过量H2SO4溶液
C.向石灰水中通入过量CO2
D.向NaAlO2溶液中逐滴加入盐酸至过量
难度: 简单查看答案及解析
-
一种新型净水剂PAFC(聚合氯化铁铝,[AlFe(OH)nCl6-n]m,,n<5,m<10},广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
A.PAFC用于净化饮用水时,可以除去水中所有的有害物质
B.PAFC中铁显+2价
C.PAFC可溶于盐酸
D.PAFC没有氧化性
难度: 中等查看答案及解析
-
一定条件下,氨气与一氧化氮发生反应:NH3+NO
N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为
A.2∶3 B.3∶2 C.4∶5 D.5∶6
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.酸性溶液中:Fe2+、ClO-、SO42-、Na+
B.pH=13的无色溶液中:K+、NO3-、Al3+、CO32-
C.澄清透明溶液中:Fe3+、Ba2+、Na+、Cl-
D.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42-
难度: 中等查看答案及解析
-
将一定量的铁粉完全溶解于某浓度的硝酸中,反应后收集到NO2和NO的混合气体,下列说法正确的是
A.反应后生成的盐只有Fe(NO3)2
B.反应后生成的盐只有Fe(NO3)3
C.反应后生成的盐为Fe(NO3)2和Fe(NO3)3
D.以上三种情况都有可能
难度: 中等查看答案及解析
-
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(部分产物已略去),下列说法错误的是
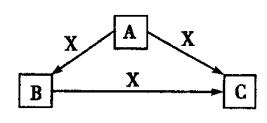
A.若X为Cl2,则C可能为Fe
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为C
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
难度: 中等查看答案及解析
-
下列依据相关实验得出的结论正确的是
A.向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32-
B.向某溶液中滴加氯水,再加入KSCN溶液,溶液变红,该溶液中一定含有Fe2+
C.向某溶液中通入Cl2后,溶液变黄,继续加淀粉溶液,溶液变蓝,说明原溶液中有I-
D.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1.12LSO3所含的原子数是0.2NA
B.3.9gNa2O2吸收足量的CO2时转移电子数是0.05NA
C.20g重水中含有中子数为8NA
D.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA
难度: 中等查看答案及解析
-
下列说法不正确的是
A.SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中
B.SiO2可与水反应生成H2SiO3
C.向氯水中加CaCO3粉末,可提高溶液中HClO的浓度
D.向氯水中滴加蓝色石蕊试液先变红后褪色
难度: 简单查看答案及解析
-
在t℃时,将agNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg•cm-3,质量分数为ω,其中含NH4+的物质的量为bmol.下列叙述正确的是
A.溶质的质量分数ω=
B.溶质的物质的量浓度c=
mol/L
C.溶液中c(OH-)=1000b/Vmol/L
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
难度: 中等查看答案及解析
-
下列类比关系正确的是
A.钠与氧气反应可生成两种不同的氧化物,则Li与氧气反应反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
难度: 中等查看答案及解析
-
FeCl3,CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.溶液中一定不含Cu2+ B.加入KSCN溶液一定不变红色
C.溶液中一定含Fe2+ D.剩余固体中一定含Cu
难度: 中等查看答案及解析
-
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液
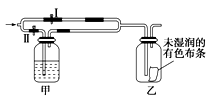
A.①②③ B.②③④ C.①②④ D.①③④
难度: 困难查看答案及解析
-
某澄清透明溶液中只可能含有①Al3+ ②Mg2+ ③Fe3+ ④Fe2+ ⑤H+ ⑥CO32- ⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
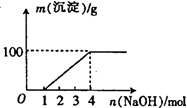
A.②⑤⑥⑦ B.②③⑤⑦ C.①②③⑥⑦ D.①②③④⑤⑦
难度: 中等查看答案及解析
-
有一种铁的“氧化物”样品,用5mol/L,盐酸200mL恰好完全溶解,所得溶液还能吸收标况下2.24L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
难度: 中等查看答案及解析
-
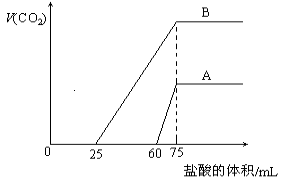
下列两种方案制备氢氧化铝:

已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是

A.a曲线表示的是向Y溶液中加入NaOH溶液
B.方案二比方案一生成更多的气体
C.在M点时,两种方案中所得溶液的溶质质量分数相同
D.M点以后,a、b两条曲线将重合为一条
难度: 困难查看答案及解析