-
水是最宝贵的资源之一。下列表述正确的是( )
A.4℃时,纯水的pH=7
B.温度升高,纯水中的c(H+) 增大,c(OH﹣)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
难度: 中等查看答案及解析
-
室温下,向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中c(OH-)增大
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7
难度: 中等查看答案及解析
-
下列水解的离子方程式正确的是( )
A.NH4++H2O
NH3·H2O+H+ B.Br-+H2O
HBr+OH-
C.CO32-+2H2O
H2CO3+2OH- D.Fe3++3H2O
Fe(OH)3↓+3H+
难度: 简单查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
难度: 简单查看答案及解析
-
在电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的( )
A.HCl B. Na2SO4 C. CuSO4 D. NaCl
难度: 简单查看答案及解析
-
下列有关电化学装置完全正确的是( )
A
B
C
D




铜的冶炼
铁上镀银
防止Fe被腐蚀
构成铜锌原电池
难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中相差不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
根据上述表格中的数据,判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式可表示为H2SO4=2H++SO
D.水对于这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
难度: 困难查看答案及解析
-
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
A.CH3CH2CH2CH3 B.CH3CH(CH3)2
C.CH3C(CH3)3 D.(CH3)2CHCH2CH3
难度: 简单查看答案及解析
-
室温下,下列各组离子在有限定条件的溶液中一定能大量共存的是( )
A.由水电离产生的c(H+)=10﹣12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3﹣
B.室温下,pH=7的溶液中:Al3+、Cl﹣、HCO3﹣、SO42﹣
C.室温下,pH=13的溶液中:K+、Cu2+、S2﹣、Cl﹣
D. pH=13的溶液中:K+、Ba2+、Cl﹣、OH﹣
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.将纯水加热至较高温度,KW变大、pH变小、呈酸性
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
难度: 中等查看答案及解析
-
室温下某强酸溶液pH=a,某强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
A.V(碱)=V(酸) B.V(酸)=100V(碱)
C.V(碱)=100V(酸) D.V(碱)=1000V(酸)
难度: 中等查看答案及解析
-
下列五种烃①2-甲基丁烷 ②2,2-二甲基丙烷 ③戊烷 ④丙烷 ⑤丁烷,按沸点由高到低的顺序排列的是( )
A.①>②>③>④>⑤ B.②>③>⑤>④>①
C.③>①>②>⑤>④ D.④>⑤>②>①>③
难度: 中等查看答案及解析
-
能说明0.1mol•L﹣1的NaHA溶液一定呈酸性的是( )
A. 某温度下,测得溶液的pH<7
B.溶液中c(Na+)=c(A2﹣)
C.溶液中存在Na+、HA﹣、A2﹣、H2A 多种微粒
D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
难度: 中等查看答案及解析
-
有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现向这两种盐的溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3 2NaR1+CO2+H2O=2HR1+Na2CO3。HR和HR1的酸性强弱比较,正确的是( )
A.HR较B弱 B.HR1较弱 C.两者相同 D.无法比较
难度: 中等查看答案及解析
-
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A.0.4 mol B.0.5 mol C.0.6 mol D.0.8 mol
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
难度: 困难查看答案及解析
-
在下图装置中,若通电一段时间后,甲装置中Cl-有剩余,乙装置左侧电极质量增加,则下列说法错误的是( )

A.乙中左侧电极反应式:Cu2++2e-=Cu
B.电解过程中装置丙的溶液pH无变化
C.向甲中通入适量的HCl气体,可使溶液恢复到电解前的状态
D.当甲装置中产生标准状况下4.48 L气体时,Cu电极上质量增加43.2 g
难度: 困难查看答案及解析
-
室温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合:2c(Na+)= c(CH3COO-)+c(CH3COOH)
难度: 困难查看答案及解析
-
将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(SO42-):c(H+)约为( )
A.1:1 B.1:2 C.1:10 D.10:11
难度: 中等查看答案及解析
-
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液,所得滴定曲线如图所示.下列说法正确的是( )
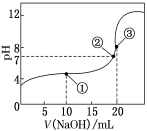
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 极难查看答案及解析
