-
化学与生活、环境密切相关,下列有关说法错误的是
A.人们用明矾对水进行消毒、杀菌
B.CO2、CH4等均是造成温室效应的气体
C.食用一定量的油脂能促进人体对某些维生素的吸收
D.自行车钢架生锈主要是电化学腐蚀所致
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,33.6L氟气中含有氟原子的数目为1.5NA
B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
D.50mL18.4mol·L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
难度: 中等查看答案及解析
-
下列相关反应的离子方程式书写错误的是
A.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:
3ClO- +4OH- +2Fe(OH)3=3Cl- +5H2O+2FeO2- 4
B.少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+SO2- 3
C.用稀硫酸酸化的KMnO4溶液与H2O2反应:2MnO- 4+6H++5H2O2=2Mn2++5O2↑+8H2O
D.SO2通入NaClO溶液中:SO2+ClO- +OH-=SO2- 4+Cl- +H+
难度: 困难查看答案及解析
-
下列有关说法错误的是
A.电解质溶液导电,使品红褪色,缓慢氧化,酸碱指示剂变色一定都属于化学变化
B.实验室中酸性高锰酸钾溶液用棕色试剂瓶保存以避免其见光分解
C.下图是纪念发现奎宁150周年邮票,邮票中的陶瓷仪器是研钵

D.用Na2O2漂白过的织物,麦秆日久又逐渐变成黄色
难度: 中等查看答案及解析
-
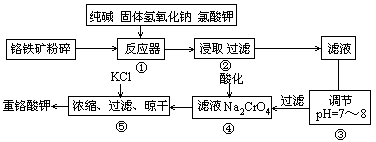
铬(Cr)与铝的性质相似,Cr(OH)3+OH- =CrO- 2+2H2O,下列推断中正确的是
A.往CrCl3溶液加入过量NaOH溶液可制得Cr(OH)3
B.对CrCl3·6H2O加热脱水可得CrCl3
C.Cr2O3既能溶于酸,又能溶于NaOH溶液
D.CrO- 2水解使溶液显酸性
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol·L-1NaClO溶液中:Fe2+、K+、I-、Cl-
B.加入铝片能放出H2的溶液中:K+、Ba2+、Cl-、NH+ 4
C.由水电离出的c(OH-)=1×10-12mol·L-1的溶液中:NH+ 4、HCO- 3、Na+、Cl-
D.c(H+)/c(OH-)=1×10-14的溶液中:K+、Na+、Cl-、SiO2- 3
难度: 困难查看答案及解析
-
下列各组物质,不能按照关系X—Y—Z—X(“—”表示反应一步完成)相互转化的是
物质 A B C D
X CaO BaCl2 Cu(NO3)2 K2SO4
Y CaCl2 Ba(NO3)2 Cu(OH)2 KCl
Z CaCO3 BaCO3 CuSO4 KNO3
难度: 中等查看答案及解析
-
实验是化学研究的基础,下列关于各实验装置的叙述正确的是
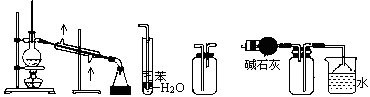
① ② ③ ④
A.装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物
B.装置②可用于吸收NH3或HCl气体,并防止到吸
C.装置③可用于收集H2、CO2、Cl2、NH3等气体
D.装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢
难度: 中等查看答案及解析
-
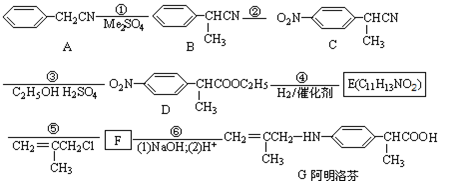
硫酸奎宁片是一种防治热病尤其是疟疾的特效药,其结构简式如图所示。下列关于硫酸奎宁的描述正确的是
A.硫酸奎宁的相对分子质量是458
B.不能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质最多可与lmolNaOH反应
难度: 中等查看答案及解析
-
再生氢氧燃料电池(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。图为RFC工作原理示意图,下列有关说法正确的是
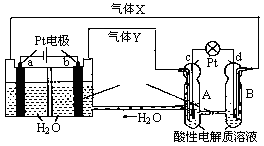
图1 图2
A.图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B.a极上发生氧化反应,产生的气体X是H2
C.图2溶液中阳离子从B极流向A极
D.c极上发生的电极反应是O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断③元素最高价氧化物对应的水化物碱性最强

B.图甲表示Zn—Cu原电池反应过程中的电流强度的变化。T时可能加入了H2O2

C.图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
D.图丙表示元素周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强
难度: 中等查看答案及解析
-
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
A.若有0.1mol氧化产物生成,则转移0.5mol电子
B.铋酸钠难溶于水
C.该反应可以用于鉴定Mn2+离子
D.该反应可以用浓盐酸酸化
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2
B.HA-比HB-更难电离,则NaHA溶液的pH一定比NaHB溶液的大
C.在饱和氨水中加入同浓度的氨水,平衡正向移动
D.某温度下,Ba(OH)2溶液中,Kw=10-12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7
难度: 中等查看答案及解析
-
25℃时,2a mol·L-1HA水溶液中(HA为弱酸)。用NaOH调节溶液pH(忽略体积变化),得到c(HA)、c(A-)与溶液pH的变化关系如下图所示。下列说法错误的是
A.当pH=3时,溶液中c(A-)>c(Na+)
B.当c(A-)>c(HA),溶液一定呈碱性
C.当pH=3.45时,c(Na+)+c(H+)=c(HA)+c(OH-)
D.当pH=4时,溶液中:c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
难度: 困难查看答案及解析
-
下述实验能达到顶期目的的是
编号 实验内容 实验目的
A 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2 溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3
B 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) 滴定其中NaOH含量
C 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 证明稀释前c(X)=10c(Y)
D 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 证明非金属性Cl>F
难度: 中等查看答案及解析
-
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)
CH3OH(g) △H<0;按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是

A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)<M(c) M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
难度: 困难查看答案及解析