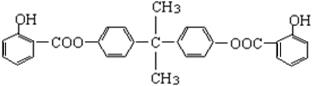
-
2015年8月12日天津港瑞海公司危险化学品仓库发生特大火灾爆炸事故,事故警示我们,化学药品的安全存放是非常重要的。下列有关化学药品的存放说法不正确的是
A.液溴易挥发,应用少量的水液封并放在冷暗处保存
B.硝酸见光易分解、易挥发,应用棕色广口试剂瓶密封保存
C.金属钠遇到氧气和水均立即反应,应保存在煤油中或者液体石蜡里
D.碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存
难度: 中等查看答案及解析
-
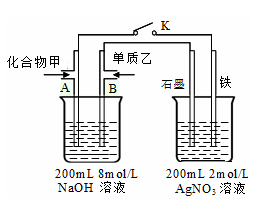
下列实验装置,其中按要求设计正确的是
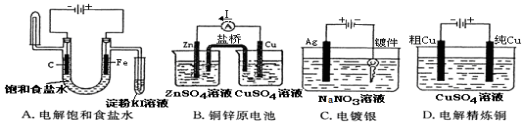
难度: 中等查看答案及解析
-
下列关于物质的分类说法正确的是
A.漂白粉、小苏打都属于纯净物
B.氯化铵、次氯酸都属于电解质
C.纯碱、烧碱都属于碱
D.合成纤维和光导纤维都是新型无机非金属材料
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法不正确的是
A.含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA
B.4.6 g Na与足量的稀盐酸反应,转移电子数一定为0.2NA
C.10.6 g Na2 CO3晶体中含CO32一数目为0.1 NA
D.常温下,22 g CO2含碳氧双键数目为NA
难度: 中等查看答案及解析
-
已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1 mol·L-1 B.1.5 mol·L-1 C.1.2 mol·L-1 D.1.0 mol·L-1
难度: 中等查看答案及解析
-
下列各组离子中,在给定条件下能够大量共存的是
A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32-
B.无色溶液中:Mg2+、MnO4-、SO42-、K+
C.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
D.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
难度: 困难查看答案及解析
-
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.原子序数:X>Y>Z D.离子半径:X2->Y+>Z-
难度: 中等查看答案及解析
-
已知下列反应: 反应Ⅰ:Co2O3 + 6HCl(浓)= 2CoCl2 + Cl2↑+ 3H2O
反应Ⅱ:5Cl2 + I2 + 6H2O = 10HCl + 2HIO3 下列说法正确的是
A.反应Ⅰ中HCl是氧化剂 B.反应Ⅱ中Cl2发生氧化反应
C.还原性:CoCl2 > HCl > I2 D.氧化性:Co2O3 > Cl2 >HIO3
难度: 中等查看答案及解析
-
下表为六种短周期元素的部分性质:
元素代号
X
Y
Z
Q
R
T
原子半径/10-10m
0.77
0.74
0.75
1.17
0.99
1.10
主要化合价
+4、
-4
-2
+5、
-3
+4、
-4
+7、
-1
+5、
-3
下列有关说法错误的是
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应的水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物XY2和XR4,其中XR4的沸点高
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
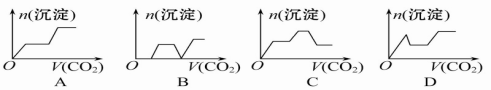
难度: 中等查看答案及解析
-
已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H= -24.8 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H= -47.2 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO (s)+CO2(g)△H= +640.5 kJ·mol-1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的反应热为
A.-109kJ•mol-1 B.-218 kJ•mol-1
C.+109 kJ•mol-1 D.+218 kJ•mol-1
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl-
C.NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
NH3↑+H2O
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
Fe3++3NO2↑+3H2O
难度: 困难查看答案及解析
-
下列图示与对应的叙述一定正确的是
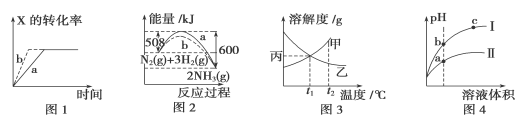
A.图1所示,反应:X(g)+2Y(g)===3Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,a表示在反应体系中加入了催化剂
C.图3所示,t1 ℃时质量分数均为20%的甲、乙两种饱和溶液,升温到t2 ℃时,两种溶液中溶质的质量分数不再相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
难度: 中等查看答案及解析
-
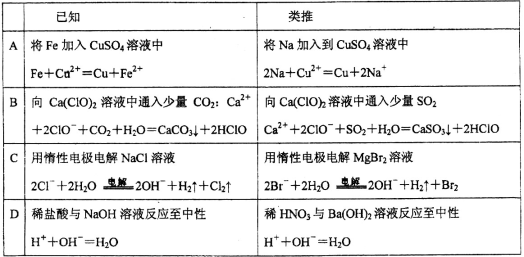
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
难度: 困难查看答案及解析
-
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M = NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH- = 6 Ni(OH)2 + NO2- 下列说法正确的是:
A.充电过程中OH- 离子从阳极向阴极迁移
B.充电过程中阴极的电极反应式:H2O + M + e- = MH + OH-,H2O中的H被M还原
C.电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
难度: 困难查看答案及解析
-
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol·L-1盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol·L-1。则原混合物中单质铁的质量是
A.2.24 g B.3.36 g C.5.60 g D.10.08 g
难度: 中等查看答案及解析
-
在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+
O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═
S2(g)+2H2O(g) △H2
H2S(g)+
O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g)△H4 则△H4的正确表达式为
A.△H4=
(△H1+△H2﹣3△H3)
B.△H4=
(3△H3﹣△H1﹣△H2)
C.△H4=
(△H1+△H2﹣3△H3)
D.△H4=
(△H1﹣△H2﹣3△H3)
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
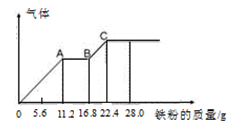
A.混合酸液中NO3-的物质的量为0.4mol
B.OA段产生是NO,AB段反应为
2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5 mol·L-1
难度: 中等查看答案及解析
-
向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是: SO42-+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
难度: 中等查看答案及解析
-
25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是
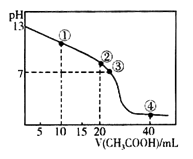
A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)> c(CH3COO-)=c(OH-)> c(H+)
难度: 中等查看答案及解析
-
已知酸性条件下有以下反应关系:①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。②Br2能将I-氧化为I2③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2。现向含有1 mol KI的硫酸溶液中加入含amol KBrO3的溶液,a的取值不同,所得产物也不同。下列判断正确的是:
编号
a的取值范围
产物的化学式
①
a≤1/6
I2、Br-
②
1/6<a<1/5
I2、Br-、Br2
③
1/5<a<6/5
I2、IO3-、Br2
④
a≥6/5
IO3-、Br2
A.①③④ B.②③④ C.①②③④ D.①④
难度: 中等查看答案及解析