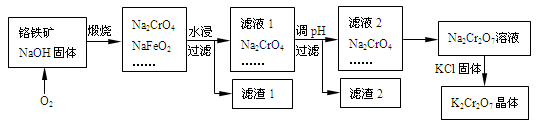
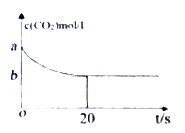
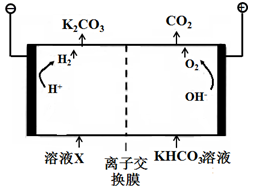
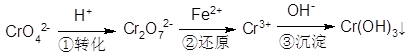-
化学在日常生活中有着广泛的应用,下列对应项不存在因果关系的是
物质性质
实际应用
A
硅胶吸水能力强
食品、药品干燥剂
B
油脂在碱性条件下水解
制肥皂
C
SiO2是酸性氧化物
光导纤维
D
Na2O2与CO2、H2O反应
潜水艇中作为氧气来源
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于有机化合物的叙述符合事实的是
A. 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应
B. 乙酸和乙醇均能与NaOH溶液发生反应
C. 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯
D. C5H11Br有8种同分异构体,它们的熔点、沸点各不相同
难度: 中等查看答案及解析
-
下列选用的仪器和药品能达到实验目的的是
A
B
C
D

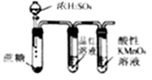

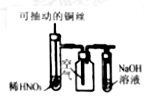
制取NaHCO3
检验反应产生的SO2
蒸馏时的接收装置
制取NO
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法中正确的是
A. 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA
B. 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子书数0.1NA
C. 25℃时,0.1mol·L-1Na2S溶液中含有Na+的数目为0.2NA
D. 将1mL5.68mol·L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体
难度: 中等查看答案及解析
-
中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途。如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
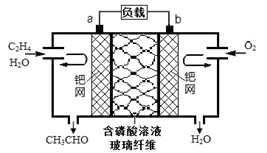
A. 该电池电极a为正极,b为负极
B. 电子移动方向:电极a→磷酸溶液→电极b
C. 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D. b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应
难度: 简单查看答案及解析
-
25℃时,在10mL浓度均为0.1mol·L-1的盐酸和醋酸混合溶液中滴加0.1mol·L-1NaOH溶液,下列有关溶液中离子浓度关系正确的是
A. 未加NaOH溶液时,c(H+)>c(Cl-)=c(CH3COOH)
B. 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+)
C. 加入NaOH溶液至PH=7时:c(Na+)=c(Cl-)
D. 加入20mLNaOH溶液时:c(Na+)=c(CH3COO-)+c(Cl-)
难度: 困难查看答案及解析
-
大庆市某中学化学实验小组在实验室鉴定某无色溶液。已知溶液中的溶质仅由NH4+、K+、Ag+、Ca2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时产生白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时产生白色沉淀乙
则下列离子在原溶液中一定存在的有
A. K+、CO32-、AlO2-
B. SO42-、AlO2-、K+、CO32-
C. CO32-、K+、Al3+、NH4+
D. MnO4-、K+、CO32-、NH4+
难度: 困难查看答案及解析