-
以下是一些常用的危险品标志,装运酒精的包装箱应贴的图标是

难度: 简单查看答案及解析
-
“玉兔”号月球车用
Pu作为热源材料。下列关于
Pu的说法正确的是
A.
Pu与
U互为同位素
B.
Pu与
Pu互为同素异形体
C.
Pu与
U具有相同的化学性质
D.
Pu与
Pu具有相同的最外层电子数
难度: 中等查看答案及解析
-
只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物。下列物质不属于氢化物的是
A.H2O B.NaH C.H2SO4 D.NH3
难度: 中等查看答案及解析
-
以下表述不符合元素周期律的是
A.酸性:H3PO4>HNO3>HClO4
B.热稳定性:HF>H2O>NH3
C.离子半径:F->Na+>Mg2+
D.还原性:HI>HBr>HCl
难度: 中等查看答案及解析
-
向盐酸中加浓H2SO4时,会有白雾生成,不是导致产生该现象的原因是
A.浓H2SO4具有脱水性
B.浓H2SO4具有吸水性
C.盐酸具有挥发性
D.气态溶质的溶解度随度随温度的升高而降低
难度: 中等查看答案及解析
-
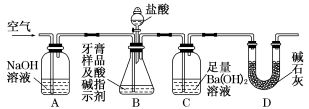
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
A.铜与浓硫酸反应所得白色固体不是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体中夹杂的少量黑色物质可能是CuO
D.白色固体中夹杂的少量黑色物质中一定含有元素Cu和S
难度: 中等查看答案及解析
-
同温同压下,在3支体积不同的试管中分别充满等体积混合的2种气体,它们是:①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中溶质的物质的量浓度分别为c1、c2、c3(假设溶质全在试管中),则下列关系正确的是
A.c1>c2>c3 B.c1>c3>c2
C.c1=c3>c2 D.c1=c2>c3
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.Cl2通入Na2CO3溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AgNO3溶液中 D.SO2通入Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
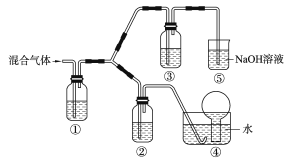
用下列实验装置能达到实验目的的是

A.比较NaHCO3和Na2CO3热稳定性大小
B.用铜和稀硝酸制取并收集少量NO
C.验证氨气在水中溶解度的大小
D.实验室用氯化铵制少量氨气
难度: 中等查看答案及解析
-
向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
A.白色沉淀为BaSO3 B.该实验表明FeCl3有还原性
C.反应后溶液酸性增强 D.反应后滴加KSCN溶液显红色
难度: 中等查看答案及解析
-
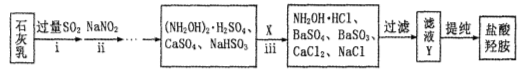
X、Y、Z是短周期的三种主族元素,在周期表中的相对位置如图所示,
下列说法正确的是
A.原子半径:X<Y<Z
B.X、Y、Z三种元素的最高价氧化物对应水化物中最多有一种强酸
C.X的气态氢化物的稳定性比Y的气态氢化物强
D.常温下X、Y、Z的单质不可能均与盐酸反应
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是
A.W、Y、Z的非金属性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子空间构型可能是正四面体
D.XZ3中含有离子键
难度: 中等查看答案及解析
-
由一种阳离子和两种酸根离子组成的盐称为混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
A.该混盐水溶液呈碱性
B.该混盐溶液加入BaCl2可以生成白色沉淀
C.该混盐与H2SO4反应有气体生成
D.该混盐在酸性条件下可生成S,每产生1molS转移1.5NA个电子
难度: 中等查看答案及解析
-
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、共价键
B.范德华力、范德华力、范德华力
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
难度: 中等查看答案及解析
-
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.
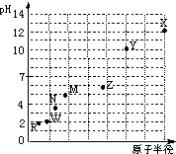
则下列说法正确的是
A.气态氢化物的稳定性:M>N
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.X和W形成的常见化合物阴阳离子个数比为1:2
D.Z和R组成的化合物是弱电解质
难度: 中等查看答案及解析
-
下列叙述正确的是
A.元素周期表中位于金属与非金属分界线附近的元素属于过渡元素
B.短周期第IVA族与VIIA族元素的原子间构成的分子,均满足原子最外层8电子结构
C.C、N、O、H四种元素形成的化合物一定既有离子键又有共价键
D.第三周期非金属元素含氧酸的酸性从左到右依次增强
难度: 中等查看答案及解析
-
一定量的镁铝合金与足量的氢氧化钠溶液反应产生3.36L氢气。若将等质量的该合金完全溶于稀硝酸,反应中硝酸被还原只产生4.48L的NO(气体的体积均已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.11.4g B.16.5g C.9.7g D.8.7g
难度: 中等查看答案及解析
-
辨析以下的说法:①l6O与 l8O的转化可以通过化学反应实现;②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;③碱性氧化物一定是金属氧化物;④只由一种元素组成的物质一定是纯净物;⑤石墨与金刚石的转化是化学变化。上述说法中正确的是
A.①④⑤ B.①③④ C.③ ⑤ D.②③
难度: 中等查看答案及解析