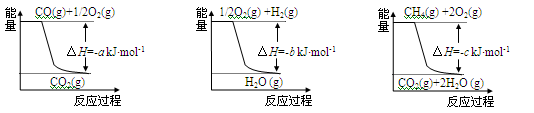
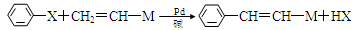-
下列说法正确的是
A.地沟油和矿物油都属于酯类物质
B.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
C.为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化
D. 蛋白质、棉花、淀粉、油脂都是由高分子组成的物质
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量
B.CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液
C.根据金属活动性顺序表,可以推断冶炼金属时可能的方法
D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行
难度: 中等查看答案及解析
-
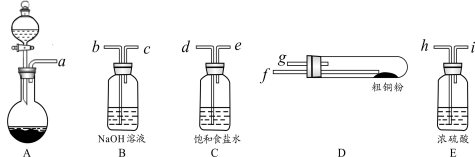
下列有关实验原理或实验操作正确的是

A.用干燥pH试纸测定某新制氯水的pH
B.用图1装置除去乙烷中混有的乙烯
C.用图2装置能验证HCl气体在水中的溶解性
D.用25mL碱式滴定管量取20.00mL KMnO4溶液
难度: 中等查看答案及解析
-
某有机物的结构简式如图,下列关于该有机物的叙述正确的是
A.该有机物的摩尔质量为200
B.该有机物属于芳香烃
C.该有机物可发生取代、加成、加聚、氧化、还原、消去反应
D.1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应
难度: 中等查看答案及解析
-
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
编号
化学反应
离子方程式
评 价
A
碳酸钙与
醋酸反应
CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
错误,碳酸钙是弱电解
质,不应写成离子形式
B
苯酚钠溶液中
通入CO2
2C6H5O-+CO2+H2O→2C6H5OH+CO32-
正确
C
NaHCO3的水解
HCO3-+H2O=CO32-+H3O+
错误,水解方程式
误写成电离方程式
D
等物质的量的FeBr2和Cl2反应
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
错误,离子方程式中
Fe2+与Br-的物质的量
之比与化学式不符
难度: 困难查看答案及解析
-
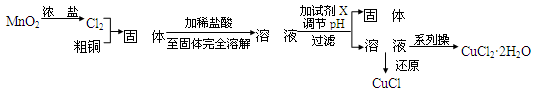
钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8,其中只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等,Y3+与W的阴离子具有相同的电子层结构,X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是
A.离子半径:X>Y
B.氢化物的稳定性:W>Z
C.化合物X2W2和Y2W3中都不含共价键
D.1 mol ZW2晶体所含Z-W键的数目为4NA(NA为阿伏加德罗常数的值)
难度: 困难查看答案及解析
-
电离度是指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数,下表中是三种酸在相同温度下的一些数据,有关判断正确的是
酸
HX
HY
HZ
浓度(mol/L)
0.12
0.2
0.9
1
1
电离度
0.25
0.2
0.1
0.3
0.5
电离常数
K1
K2
K3
K4
K5
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ混合后,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
难度: 极难查看答案及解析