-
下列与化学有关的表述正确的是
A.生物质能源是可再生能源,缺点是严重污染环境
B.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
C.对“地沟油”进行分馏可以得到汽油
D.可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素
难度: 中等查看答案及解析
-
是重要的核工业原料,但在自然界的丰度很低,
的浓缩一直为国际社会关注。下列有关:
说法正确的是
A.
与
互为同位素
B.
原子核外有143个电子
C:
与
是同一种核素
D.
原子核中含有92个中子
难度: 中等查看答案及解析
-
下列金属中,通常采用热还原法冶炼的是
A.Na B.Al C.Fe D .Ag
难度: 中等查看答案及解析
-
某元素的原子最外层只有一个电子,它跟卤族元素结合时形成的化学键
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.上述说法都不正确
难度: 中等查看答案及解析
-
在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是
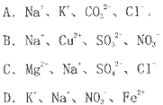
难度: 中等查看答案及解析
-
W、X、Y、Z是短周期元素,其部分性质如下表

下列说法正确的是
A.气态氢化物的热稳定性:X>W B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W D.Z的氧化物中含有非极性共价键
难度: 中等查看答案及解析
-
反应
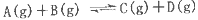 过程中的能量变化如图所示,下列说法错误的是
过程中的能量变化如图所示,下列说法错误的是
A.该反应是吸热反应
B.加入催化剂后,反应加快,A的转化率不变
C.反应物的总键能小于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
难度: 中等查看答案及解析
-
下列物质中,在一定条件下能发生取代反应和加成反应,但不能使酸性高锰酸钾溶液褪色的是
A..苯 B.甲烷 C.乙烷 D.乙烯
难度: 中等查看答案及解析
-
下列对“化学反应速率”的理解正确的是
A.化学反应速率表示的是化学反应进行的限度
B.化学反应速率可以用单位时间内反应物浓度的减少量来表示
C. 对于任何化学反应来说,反应速率越快,反应现象就越明显
D.化学反应速率可以是正值,也可以是负值
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
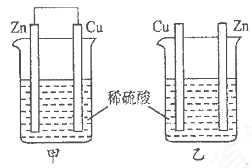
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱 D.产生气泡的速率甲比乙慢
难度: 中等查看答案及解析
-
下列有关同分异构体数目的叙述中,错误的是
A.C8H10中只有4种属于芳香烃的同分异构体
B. CH3CH2CH2CH3光照下与氯气反应,生成2种一氯代烃
C.戊烷有3种同分异构体
D.甲苯苯环上的一个氢原子被丙基取代,所得产物有3种
难度: 中等查看答案及解析
-
将0.2mol丁烷完全燃烧后生成的气体全部缓慢通入0.5L2mol/LNaOH溶液中,生成的Na2CO3和NaHCO3的物质的量之比为
A. 3:2 B. 2:3 C.2:1 D. l:3
难度: 中等查看答案及解析
-
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为
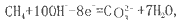 ,下列叙述正确的是
,下列叙述正确的是A.通入甲烷的一极为正极
B.通入氧气的一极发生氧化反应
C.该电池总反应为
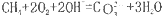
D.该电池在工作时,溶液中的阴离子向正极移动
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 ml B.45 ml. C.30 mL D.15mL
难度: 中等查看答案及解析
-
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为

下列相关说法不正确的是
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.l mol苹果酸与足量Na反应生成33. 6 L H2
D.1 mol苹果酸能与含1molNa2CO3 的溶液恰好完全反应
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中发生如下反应:
 B、C的物质的量随时间变化的关系如图l,达平衡后在
B、C的物质的量随时间变化的关系如图l,达平衡后在时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
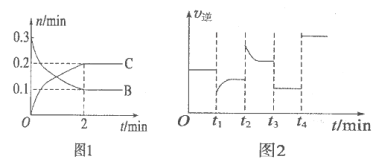
A.x=2,反应开始2 min内
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c (B)不变
难度: 中等查看答案及解析
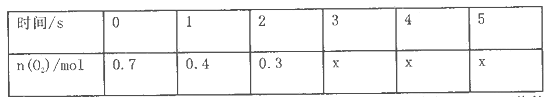
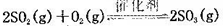 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表