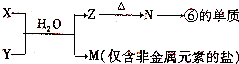-
将pH=3的盐酸a L 分别与下列三种溶液混合后,混合液均呈中性;
①1×10-3mol-1的氨水bL
②c(OH-)1×10-3mol-1的氨水cL
③c(OH-)1×10-3mol-1的Ba(OH)2的溶液dL
其中a、b、c、d的关系正确的是( )
A.b>a=d>c
B.a=b>c>d
C.a=b>d>c
D.c>a=d>b难度: 中等查看答案及解析
-
在含有I-且能使甲基橙试液变红的溶液中能大量共存的离子组为( )
A.Fe3+、Na+、Br-、
B.NH4+、Na+、AlO2-
C.Ba2+、Al3+、Cl-、
D.K+、MnO4-、NO3-难度: 中等查看答案及解析
-
下列有关金属的说法中,不正确的是( )
A.青铜、不锈钢、赢铝都是合金
B.铜表面易形成致密的氧化膜
C.工业上用电解熔融MgCl2的方法制取金属镁
D.铝是活泼金属,但在空气中耐腐蚀难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.乙烯的结构简式CH2CH2
B.氧化钠的电子式
C.明矾的化学式KAISO4•12H2O
D.乙酸乙酯的分子式C4H8O2难度: 中等查看答案及解析
-
NaCl、Cl2、NaClO、Cl2O3、HClO4是按某一规律排列的.下列物质中也完全按照此规律排列的是( )
A.CH4、Na2CO3、C、CO2、NaHCO3
B.Na2S、S、SO2、Na2SO3、H2SO4
C.NH3、N2、NO、NO2、NaNO3
D.P2O5、H3PO4、Na3PO4、Na2HPO4、NaH2PO4难度: 中等查看答案及解析
-
在四种化合物①NaHCO3、②Al(OH)3、③(NH4)2S、④
中,跟盐酸和氢氧化钠溶液都能反应的是( )
A.只有②④
B.只有①②
C.只有①②③
D.①②③④难度: 中等查看答案及解析
-
对于反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)△H=-444.3kJ/mol,在常温常压下能自发进行,对反应的方向起决定作用的是( )
A.焓变
B.温度
C.压强
D.熵变难度: 中等查看答案及解析
-
用下列实验装置进行的实验,能达到相应实验目的是( )
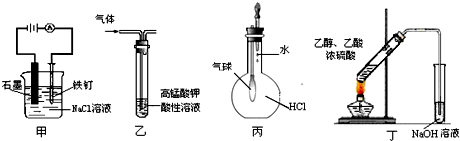
A.装置甲:防止铁钉生锈
B.装置乙:除去乙烯中混有的乙炔
C.装置丙:验证HCl气体在水中的溶解性
D.装置丁:实验室制取乙酸乙酯难度: 中等查看答案及解析
-
下列关于常见的有机物的说法中不正确的是( )
A.乙酸和油脂都能与氢氧化钠反应
B.苯和甲烷都不能使酸性高锰酸钾溶液褪色
C.乙烯和甲烷不能用溴的四氯化碳溶液鉴别
D.糖类和蛋白质都是人体重要的营养物质难度: 中等查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同( )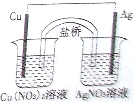
A.①②
B.①②④
C.②③
D.①③④难度: 中等查看答案及解析
-
已知常温下红磷比白磷稳定,在下列反应中:
4P(红磷,s)+5O2(g)=2P2O5(s)-△H=-akJ•mol-1
4P(白磷,s)+5O2(g)=2P2O5(s)-△H=-bkJ•mol-1( )
A.a<b
B.a=b
C.a>b
D.无法确定难度: 中等查看答案及解析
-
主链上有5个碳原子,含甲基,乙基两个支链的烷烃有( )
A.5种
B.4种
C.3种
D.2种难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.lmolN2O2与水完全反应时转移电子的数目为NA
B.标准状况下,22.4L水中含有水分子的数目为NA
C.将0.1molFeCl3水解制成胶体,所得胶体粒子数为0.1NA
D.1L0.1mol•L-1乙酸溶液中H+数为0.1NA难度: 中等查看答案及解析
-
向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中各离子数目也相应地发生变化.溶液中各离子数目与图中四条曲线的对应关系完全正确的是( )
a b c d A Cl- K+ CO32- HCO32- B K+ CO32- Cl- HCO32- C K+ CO32- HCO32- Cl- D K+ HCO32- Cl- CO32- 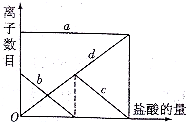
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在同温同压下,某有机物和过量Na反应得到V1L氢气,另一份等量的该有机物和足量的NaHCO3反应得到V2L二氧化碳,若V1=V2≠0,则该有机物可能是( )
A.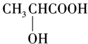
B.HOOC-COOH
C.HOCH2CH2OH
D.CH3COOH难度: 中等查看答案及解析
-
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可能确定有Cl-存在
B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I一存在
C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在难度: 中等查看答案及解析
-
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为( )
A.Mg2+
B.Fe2+
C.CO32-
D.Ba2+难度: 中等查看答案及解析
-
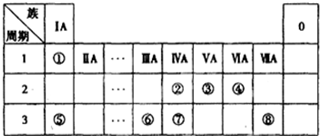
元素X的单质及X与Y形成的化合物能按下图所示的关系发生转化,下列说法不正确的是( )

A.X可能是金属
B.X可能是非金属
C.n可以等于2或3
D.XYm与XYn的相互转化是可逆反应难度: 中等查看答案及解析