-
下列有关表述正确的是 ( )
A.次氯酸的电子式:
B. N原子的电子排布图为:

C.硫原子的价电子排布式:3s23p4
D.二氧化硅的分子式: SiO2
难度: 简单查看答案及解析
-
下列过程没有破坏化学键的是( )
A.2O3 = 3O2 B.干冰升华 C.金刚石受热融化 D.HCl气体溶于水
难度: 简单查看答案及解析
-
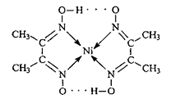
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
难度: 简单查看答案及解析
-
下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移的是( )
A.BeCl2 B.PCl3 C.PCl5 D.N2
难度: 简单查看答案及解析
-
下列关于丙烯(CH3—CH =CH2)的说法正确的( )
A. 丙烯分子有7个δ键,1个π键
B. 丙烯分子中3个碳原子都是sp3杂化。
C. 丙烯分子存在非极性键
D. 丙烯分子中3个碳原子在同一直线上。
难度: 简单查看答案及解析
-
在基态多电子原子中,关于核外电子的叙述正确的是 ( )
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.电子从低能级跃迁到高能级的过程中一定要释放能量
C.在同一能级上运动的电子,其运动状态一定完全相同
D.能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动
难度: 简单查看答案及解析
-
已知Be在周期表中位于Al的左上方,则下列有关Be的说法中错误的是 ( )
A.单质Be与酸或碱反应都能放出氢气 B.Be(OH)2为两性氢氧化物
C.Be的氧化物的化学式为Be2O3 D.BeCl2晶体属于分子晶体
难度: 简单查看答案及解析
-
下列变化或数据与氢键无关的是( )
A.水凝结成冰时,密度变小 B.氨分子与水分子生成一水合氨
C.水在2000℃时,只有4%的H2O发生分解 D.水的沸点比同主族元素氢化物的高
难度: 简单查看答案及解析
-
下列各组微粒属于等电子体的是 ( )
A.C2H2和N2 B.NO和NO2
C.CH4和NH3 D.CO2和N2O
难度: 简单查看答案及解析
-
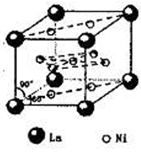
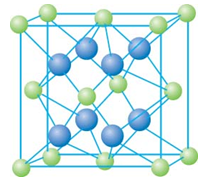
有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为( )
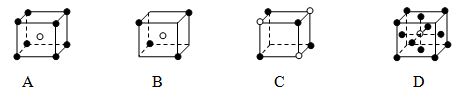
难度: 简单查看答案及解析
-
下列各组无机酸的酸性强弱比较正确的是 ( )
A. HClO>HClO2>HClO3>HClO4 B. HF<HCl<HBr<HI
C. H2CO3<H2SiO3<H2GeO3 D. HNO3<H3PO4
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6
B.所有的非金属元素都分布在p区
C.原子核外电子排布式为1s1的原子与原子核外电子排布式为1s22s1的原子的化学性质相似
D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称过渡金属元素
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:③>②>①
B.原子半径:③>②>①
C.电负性:③>②>①
D.最高正化合价:③>②>①
难度: 简单查看答案及解析
-
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是( )
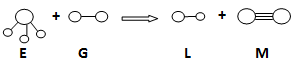
A.G是最活泼的非金属单质 B.L的稳定性小于E
C.E能使紫色石蕊试液变蓝色 D.M化学性质比较稳定
难度: 简单查看答案及解析
-
Na3N是离子化合物,它能与水反应生成氨气。下列关于Na3N的说法中错误的是( )
A.在Na3N与水反应中Na3N是还原剂
B.Na3N与盐酸反应时生成两种盐
C.Na3N分子中Na+的半径比N3-的半径小
D.Na+ 与 N3-的核外电子排布都与氖原子的相同
难度: 简单查看答案及解析
-
共价键、离子键、金属键、范德华力和氢键都是微观粒子之间的不同作用力,下列物质:①Na2O2;②冰;③金刚石;④碘单质;⑤CaCl2;⑥白磷,其中只含有两种作用力的组合是 ( )
A.①④⑥ B.①③⑥ C.②④⑥ D.①②③⑥
难度: 简单查看答案及解析
-
下列叙述不正确的是 ( )
A.在干冰晶体中,每一个二氧化碳分子周围有12个二氧化碳分子紧密相邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D.在12g金刚石晶体中 ,含共价键为2NA
难度: 简单查看答案及解析
-
“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的( )
A.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;
则第三周期元素氢化物的稳定性顺序是:HCl>H2S>PH3
B.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;
则VA族元素氢化物沸点顺序是:AsH3>PH3>NH3
C.二甲苯的沸点顺序是:邻二甲苯>对二甲苯;
则羟基苯甲醛的沸点顺序是:邻羟基苯甲醛 >对羟基苯甲醛
D.根据“相似相溶”,乙醇能与水以任意比互溶,则戊醇也能与水以任意比互溶
难度: 简单查看答案及解析
-
下列化合物中含有2个手性碳原子的是 ( )

难度: 简单查看答案及解析
-
已知CsCl晶体的密度为
,NA为阿伏加德罗常数,相邻的两个
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
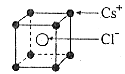
A.
B.
C.
D.
难度: 简单查看答案及解析