-
下列叙述正确的是
A.物质燃烧不一定是放热反应
B.放热反应不需要从外界吸收任何能量就能发生
C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量
D.化学反应除了生成新的物质外,还伴随着能量的变化
难度: 简单查看答案及解析
-
已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A.H2O ( g ) = H2 ( g ) + 1/2O2 ( g ) △H = +242 kJ/mol
B.2H2 ( g ) + O2 ( g ) = 2H2O ( l ) △H = -484 kJ/mol
C.H2 ( g ) + 1/2O2 ( g ) = H2O ( g ) △H = +242 kJ/mo
D.2H2 ( g ) + O2 ( g ) = 2H2O ( g ) △H = +484 kJ/mol
难度: 简单查看答案及解析
-
已知:(1)Zn(s)+ 1/2O2(g)==ZnO(s) ΔH = -348.3kJ/mol
(2)2Ag(s) +1/2 O2(g)== Ag2O(s) ΔH = -31.0kJ/mol
则Zn(s)+ Ag2O(s) == ZnO(s) + 2Ag(s) 的ΔH等于
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol /(L·s) B.υ(B)= 0.3 mol /(L·s)
C.υ(C)= 0.8 mol /(L·s) D.υ(D)= 1 mol /(L·s)
难度: 简单查看答案及解析
-
一定条件下反应2AB(g)
A2(g)+B2(g) 达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,三种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
难度: 简单查看答案及解析
-
对于可逆反应C(s)+H2O(g)
CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是
A. K=c(C)·c(H2O)/ c(CO)·c(H2) B. K= c(CO)·c(H2)/c(C)·c(H2O)
C. K=c(H2O)/ c(CO)·c(H2) D. K=c(CO)·c(H2)/ c(H2O)
难度: 简单查看答案及解析
-
反应:L(s)+aG(g)
bR(g) 达到平衡时,温度和压强对该反应的影响如右图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断:
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.1+a<b
难度: 简单查看答案及解析
-
符合下列条件的化学反应肯定是自发的是
A.△H<0,△S>0 B.△H<0,△S<0
C.△H>0,△S>0 D.△H>0,△S<0
难度: 简单查看答案及解析
-
右图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
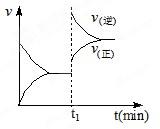
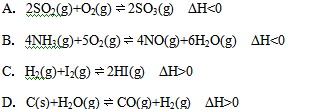
难度: 简单查看答案及解析
-
右图为可逆反应A(g)+2B(g)
nC(g) (正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强P1、P2的关系正确的是

A. P2>P1,n<3 B. P2>P1,n>3
C. P1>P2,n<3 D.P1>P2,n>3
难度: 简单查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
B.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
C.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
D.含碳酸氢钠的溶液:K+、SO42-、Cl-、H+
难度: 简单查看答案及解析
-
在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,下列说法中正确的是
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.只有盐酸和硝酸中放出的氢气量相等
难度: 简单查看答案及解析
-
下列措施能使水的电离程度增大的是( )
A. 加热 B. 加入硫酸溶液 C. 加入氢氧化钠溶液 D. 降温
难度: 简单查看答案及解析
-
下列溶液肯定显酸性的是 ( )
A. 含H+的溶液 B. c(H+)=1×10-7mol·L-1 C. pH<7的溶液 D. c(OH-)<c(H+)的溶液
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH= 4
C.0.2 mol•L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
难度: 简单查看答案及解析
-
有一支50ml酸式滴定管,其中盛的溶液恰好在10.00ml刻度处,现把管内溶液全部流下排出,并且量筒承接,所得溶液的体积为
A.10 ml B.小于10ml C.40 ml D.大于40ml
难度: 简单查看答案及解析
-
下列物质的溶液呈碱性的是
A. Na2CO3 B. Na2SO4 C. NH4NO3 D. CH3COOH
难度: 简单查看答案及解析
-
在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A.等于0.6mol B.等于1mol
C.大于0.6mol且小于1mol D.大于1mol
难度: 简单查看答案及解析