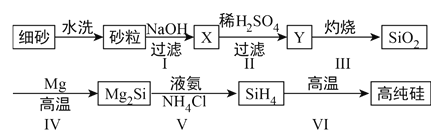
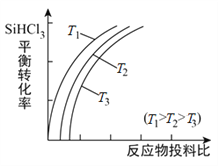
-
下列陈述正确并且有因果关系的是( )
A. SiO2有导电性,可用于制备光导纤维
B. 浓硫酸具有氧化性,可用于干燥H2
C. Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
D. FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
难度: 简单查看答案及解析
-
实验室常用NaNO2和NH4Cl反应制取N2。下列有关说法正确的是
A. NaNO2是还原剂
B. NH4Cl中N元素被还原
C. 生成1 mol N2时转移6 mol电子
D. 氧化剂和还原剂的物质的量之比是1:1
难度: 中等查看答案及解析
-
将SO2气体通入BaCl2溶液中,未见沉淀生成。若同时通入另一种气体X则有沉淀生成。则X气体不可能是( )
A. H2S B. NH3 C. CO2 D. NO2
难度: 中等查看答案及解析
-
下列解释事实的方程式正确的是( )
A. 将NO2通入水中,红棕色消失:3NO2+H2O=2HNO3+O2
B. 漂白粉实现漂白性:CO2+2ClO-+H2O=CO32-+2HClO
C. Na与水反应产生气体:Na+H2O=Na++OH-+H2↑
D. 燃煤时加入石灰石可减少SO2的排放:2CaCO3+O2+2SO2
2CaSO4+2CO2
难度: 简单查看答案及解析
-
肼(N2H4)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示。肼能与双氧水发生反应N2H4+2H2O2===N2+4H2O,用NA表示阿伏加德罗常数的值。下列说法正确的是
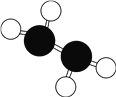
A. 标准状况下,11.2 L N2中含有的电子总数为5NA
B. 标准状况下,22.4 L N2H4中含有的原子总数为6NA
C. 标准状况下,3.2 g N2H4中含有共价键的总数为0.6NA
D. 若生成3.6 g H2O,则上述反应转移电子的数目为0.2NA
难度: 中等查看答案及解析
-
聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下,下列说法不正确的是( )
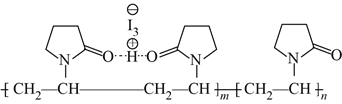 (图中虚线表示氢键)
(图中虚线表示氢键)A. 聚维酮的单体是
B. 聚维酮分子由(m+n)个单体聚合而成
C. 聚维酮碘是一种水溶性物质 D. 聚维酮在一定条件下能发生水解反应
难度: 简单查看答案及解析
-
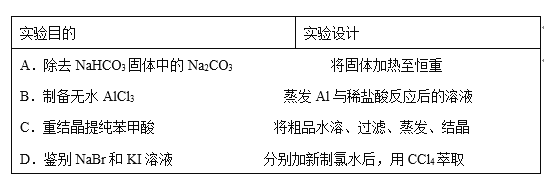
下列有关实验的选项正确的是( )
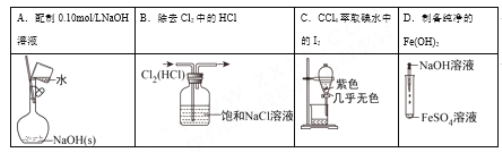
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
根据元素周期表和元素周期律,下列叙述不正确的是( )
A. 气态氢化物的稳定性:HF>H2O>NH3
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 右图所示实验可证明元素的非金属性:Cl>C>Si
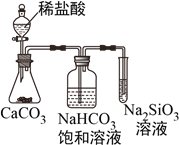
D. 第118号元素在周期表中位于第七周期0族
难度: 简单查看答案及解析
-
氢氧化铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解25.25g二者的混合物,恰好消耗1.0mol·L-1盐酸500mL。灼烧等量的上述混合物,得到的氧化铜质量为( )
A. 15g B. 20g C. 30g D. 35g
难度: 中等查看答案及解析
-
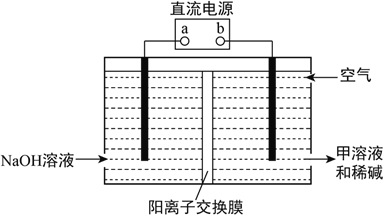
某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,转化关系如下如所示:下列说法不正确的是( )

A. x为NaOH溶液,y为盐酸
B. a→b发生的反应为:AlO2-+H++H2O=Al(OH)3↓
C. 按照本流程,x和y调换后也能达到实验目的
D. b、c既能与强酸又能与强碱反应
难度: 中等查看答案及解析
-
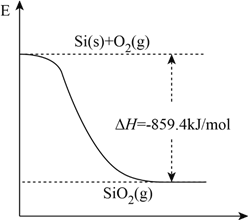
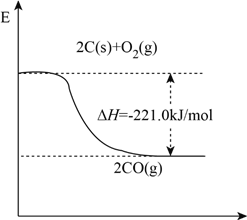
黑火药是中国古代的四大发明之一,其爆炸的热化学方程为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ∆H=xkJ·mol-1,已知:①碳的燃烧热∆H1=akJ·mol-1;②S(s)+2K(s)=K2S(s) ∆H2=bkJ·mol-1;③2K(s)+N2(g)+3O2(g)=2KNO3(s) ∆H3=ckJ·mol-1。则x为( )
A. 3a+b-c B. c+3a-b C. a+b-c D. c+a-b
难度: 中等查看答案及解析
-
由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)
COS(g)+H2(g),数据如下表所示:
实验
温度/℃
起始时
平衡时
n(CO)/mol
n(H2S)/mol
n(COS)/mol
n(H2)/mol
n(CO)/mol
1
150
10.0
10.0
0
0
7.0
2
150
7.0
8.0
2.0
4.5
a
3
400
20.0
20.0
0
0
16.0
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大
难度: 中等查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
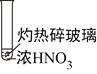
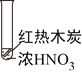

①
②
③
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. 由③推测浓硝酸具有挥发性,生产的红棕色气体为还原产物
D. ③的气体产物中检测处CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 简单查看答案及解析