-
高纯硅晶体是信息技术的重要材料。
(1)工业上用石英和焦炭可以制得粗硅。已知反应过程的能量变化如下图
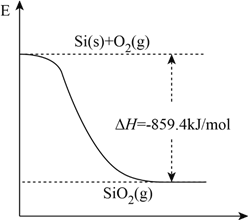
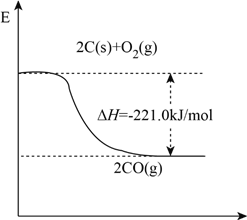
写出用石英和焦炭制取粗硅的热化学方程式______________________________。
(2)某同学设计下列流程制备高纯硅:
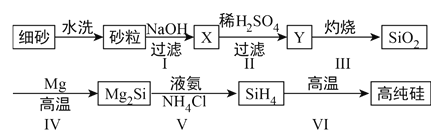
①Y的化学式为____________________。
②写出反应I的离子方程式________________________________________。
③写出反应IV的化学方程式________________________________________。
④甲烷分解的温度远远高于硅烷(SiH4),用原子结构解释其原因______________________。
(3)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:SiHCl3(g)+H2(g) Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
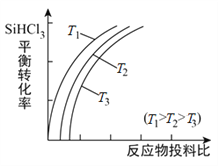
A.该反应是放热反应
B.横坐标表示的投料比可以是
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
-
高纯硅晶体是信息技术的重要材料。
(1)工业上用石英和焦炭可以制得粗硅。已知反应过程的能量变化如下图
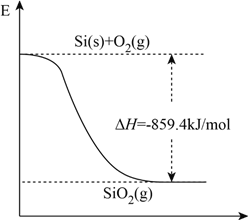
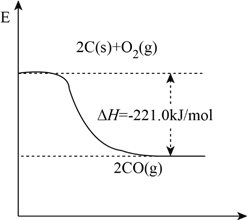
写出用石英和焦炭制取粗硅的热化学方程式______________________________。
(2)某同学设计下列流程制备高纯硅:
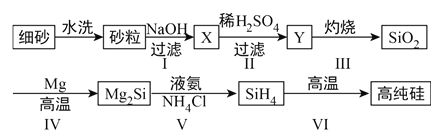
①Y的化学式为____________________。
②写出反应I的离子方程式________________________________________。
③写出反应IV的化学方程式________________________________________。
④甲烷分解的温度远远高于硅烷(SiH4),用原子结构解释其原因______________________________。
(3)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:SiHCl3(g)+H2(g)  Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。

A.该反应是放热反应
B.横坐标表示的投料比可以是
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
-
(14分)高纯硅晶体是信息技术的重要材料。
(1)在周期表的以下区域中可以找到类似硅的半导体材料的是______(填字母)。
A.过渡元素区域 B.金属和非金属元素的分界线附近
(2)工业上用石英和焦炭可以制得粗硅。已知:
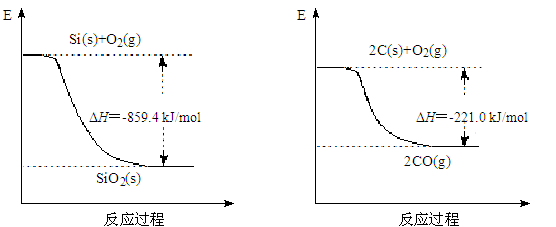
写出用石英和焦炭制取粗硅的热化学方程式 ______。
(3)某同学设计下列流程制备高纯硅:
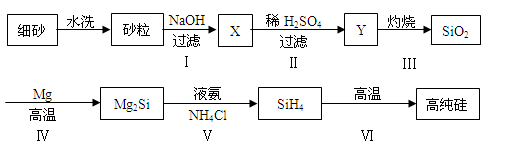
①Y的化学式为______。
②写出反应Ⅰ的离子方程式 。
③写出反应Ⅳ的化学方程式 。
④步骤Ⅵ中硅烷(SiH4)分解生成高纯硅,已知甲烷分解的温度远远高于硅烷,用原子结构解释其原因是 。
(4)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:
SiHCl3 (g) + H2(g)  Si(s) + 3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是 (填字母)。
Si(s) + 3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是 (填字母)。
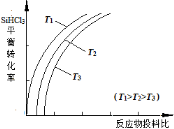
A.该反应是放热反应
B.横坐标表示的投料比应该是
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
-
单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。
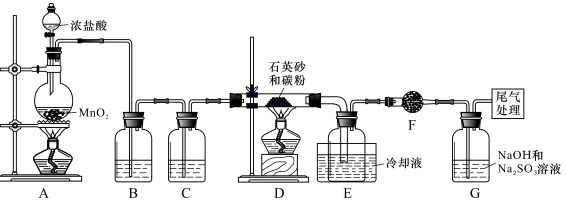
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见右表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 华温度/℃ | - | 180 | 300 |
请回答下列问题:
(1)装置B中的试剂是____________,装置D的硬质玻璃管中发生反应的化学方程式是_______________。
(2)D、E间导管短且粗的原因是________________________。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:____________。
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4、1mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
| 序号 | 操 作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 |
| ② | 向b试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 |
| ③ | 向c试管中滴加几滴 溶液 | | 假设3成立 |
-
单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。
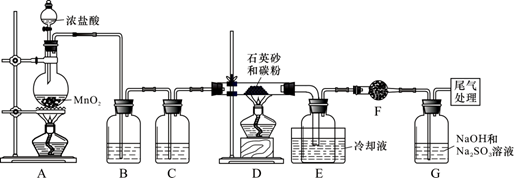
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解 ,有关物质的物理常数见下表:
,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是________。
 (2)装置C中的试剂是________; D、E间导管短且粗的原因是________。
(2)装置C中的试剂是________; D、E间导管短且粗的原因是________。
 (3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3: 。
【设计方案,进行实验】可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
| 序号 | 操 作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴________溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 |
| ② | 向b试管中滴加几滴溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 |
| ③ | 向c试管中滴加几滴________溶液 | ________ | 假设3成立 |
-
工业上用焦炭与石英在高温下氮气流中发生如下反应,3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g) +Q(Q>0),可制得一种新型陶瓷材料氮化硅(Si3N4),该材料熔点高,硬度大 ,广泛应用于光伏、轴承、冶金、化工、能源、环保等行业。回答下列问题:
Si3N4(s)+6CO(g) +Q(Q>0),可制得一种新型陶瓷材料氮化硅(Si3N4),该材料熔点高,硬度大 ,广泛应用于光伏、轴承、冶金、化工、能源、环保等行业。回答下列问题:
(1)N2的电子式为____________,Si在元素周期表中的位置是_______________,氮化硅晶体属于__________晶体。
(2)该反应中,还原产物是______________。若测得反应生成22.4 L CO气体(标准状况下),则转移的电子的物质的量为_____________。
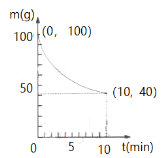
(3)该反应的平衡常数表达式K=__________________;若其他条件不变,降低温度,达到新的平衡时,K值____________(填“增大”、“减小”或“不变”,以下同)。CO的浓度_________,SiO2的质量______________。
(4)已知在一定条件下的2L密闭容器中制备氮化硅,SiO2(纯度98.5%,所含杂质不与参与反应)剩余质量和反应时间的关系如右图所示。CO在0~10min的平均反应速率为 _______ 。
(5)现用四氯化硅、氮气和氢气在高温下发生反应,可得较高纯度的氮化硅。反应的化学方程式为______________。
-
工业上用自然界存在的角膜硼镁矿 主要成分为
主要成分为 制取金属镁和粗硼,工艺过程如下:
制取金属镁和粗硼,工艺过程如下:
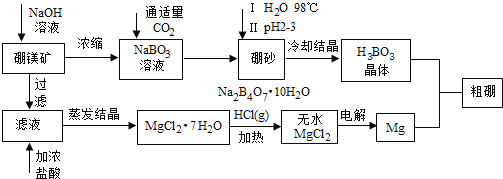
根据以上信息回答下列问题:
(1)硼砂中硼的化合价 ______ ,溶于热水后,若需要调节pH为 制取硼酸,写出该反应的离子方程式: ______ 。
制取硼酸,写出该反应的离子方程式: ______ 。
(2)从氯化镁晶体制得无水氯化镁的条件是 ______ ;其理由是 ______ ,若用惰性电磁电解 溶液,写出电解过程的离子方程式: ______ 。
溶液,写出电解过程的离子方程式: ______ 。
(3)制得的粗硼可在一定条件与 作用生产
作用生产 ,再提纯
,再提纯 ,
, 沸点较低,提纯可采用 ______ ;高温时
沸点较低,提纯可采用 ______ ;高温时 即可分解,得到高纯度硼。根据分解生成碘的量还可以测定粗硼的粗度。方法如下:
即可分解,得到高纯度硼。根据分解生成碘的量还可以测定粗硼的粗度。方法如下:
称取 粗硼转化成纯
粗硼转化成纯 ,再完全分解,生成的碘用
,再完全分解,生成的碘用 的
的 溶液滴定至终点,消耗标准液
溶液滴定至终点,消耗标准液 滴定原理:
滴定原理:
①滴定终点判断应用 ______ 作指示剂;
②标准液应盛装在 ______ 滴定管中;
③该粗硼的纯度为 ______ 。
(4) 酸性染料电池的反应机理为:
酸性染料电池的反应机理为: ,则电池正极反应式为 ______ ;常温下,若起始电解液
,则电池正极反应式为 ______ ;常温下,若起始电解液 ,则电池工作一段时间后,电解液
,则电池工作一段时间后,电解液 ,此时溶液中
,此时溶液中 ______ ;当溶液
______ ;当溶液 时,镁元素的主要存在形式是 ______ 。
时,镁元素的主要存在形式是 ______ 。 已知:
已知:
-
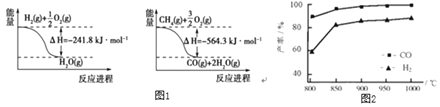
合成氨工业中的原料气制取与净化是重要的环节。
(1)已知有关反应的能量变化如图1:写出 与
与 反应制取
反应制取 和
和 的热化学方程式:______。
的热化学方程式:______。
(2)“ 催化重整法”制氢气:
催化重整法”制氢气: ,
, 不仅可以得到合成气
不仅可以得到合成气 和
和 ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的 ______
______ 。
。
| 化学键 | C-H | C=O | H-H |  
|
| 键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入 和
和 ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将 、
、 以及催化剂进行加入
以及催化剂进行加入 容器中,达到平衡时
容器中,达到平衡时 ,平衡常数
,平衡常数 ______
______ 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜 Ⅰ
Ⅰ 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是: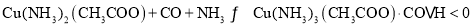 ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜 Ⅰ
Ⅰ 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______ 填序号
填序号 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
-
单晶硅是信息产业中重要的基础材料。工业上可用焦炭与石英砂(SiO2)的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备 SiCl4的装置示意图:
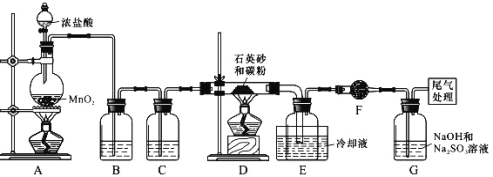
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | — | 315 |
| 熔点/℃ | -70.0 | — | — |
| 升华温度/℃ | — | 180 | 300 |
(1)装置B中的试剂是_______,装置 D 中制备SiCl4的化学方程式是______。
(2) D、E 间导管短且粗的作用是______。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-,请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
(提出假设)假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:______。
(设计方案进行实验)可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/LKMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加 3 mol/L H2SO4 至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴_____溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 |
| ② | 向b试管中滴加几滴_____溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 |
| ③ | 向c试管中滴加几滴_____溶液 | _____ | 假设3成立 |
-
工业上可以利用废气中的CO2为原料制取甲醇。请回答下列问题:
(1) 已知常温常压下,下列两个可逆反应的能量变化如下图所示:
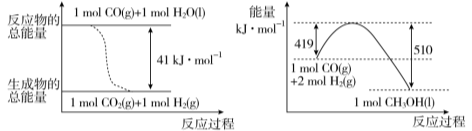
请写出左图反应的平衡常数表达式K= 。
请写出由二氧化碳和氢气制备甲醇的热化学方程式 。
(2) 如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应________(选填编号)。
A.一定向正反应方向移动 B.在平衡移动时,正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时,逆反应速率先减小后增大
(3) 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填字母)。
A.H2的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时,n(H2)/n(CH3OH)增大
(4) 保持温度和体积不变,通入1molCO2和3molH2 ,下列能说明该反应已达平衡状态的是________(填字母)。
,下列能说明该反应已达平衡状态的是________(填字母)。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CO2的消耗速率之比为3∶1
D.容器内气体的平均相对分子质量保持不变
(5) 若反应容器的容积为2.0 L,反应时间4.0 min,容器 内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
(6) 有人设计甲醇-空气燃料电池电源, 用石墨作电极电解200 mL含有下列离子的溶液:
用石墨作电极电解200 mL含有下列离子的溶液:
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为____________(忽略溶液体积的变化及电极产物可能存在的溶解现象)。也有人用此电源利用电解法制备Na2FeO4,阳极材料为铁,其电解质溶液用NaOH溶液,阳极反应式为 。



Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。













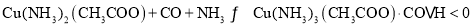 ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜
