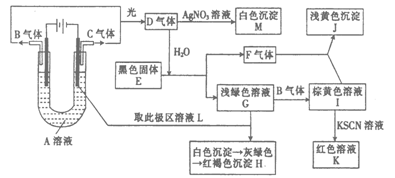
-
观察下列几个装置示意图,有关叙述正确的是
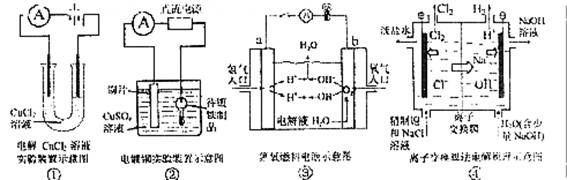
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中闭合电键后外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
难度: 简单查看答案及解析
-
根据以下四个反应:(1)H2S+I2=2H++2I-+S¯ (2)H2SO3+2H2S=3S¯+3H2O
(3)2I-+Br2=2Br-+I2 (4)H2SO3+I2+H2O=H2SO4+2HI
确定Br-、I-、H2S和H2SO3还原性由强到弱的顺序是
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S
C.H2SO3>H2S>Br->I- D.I->Br->H2S>H2SO3
难度: 简单查看答案及解析
-
已知A+B=C+D为放热反应,对该反应的下列说法正确的是
A.A的能量一定高于C B.反应中A与B的总能量一定高于C与D的总能量
C.B的能量一定高于D D.因该反应是放热反应,故不加热该反应就能反应
难度: 简单查看答案及解析
-
用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解,此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8mol
D.原某浓度的NaCl溶液中溶有117g NaCl
难度: 简单查看答案及解析
-
一种新型燃料电池,它是用两根惰性金属做电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,发生的电极反应为: X极:CH4+10OH-―8e-=CO32-+7H2O Y极:4H2O+2O2+8e-=8OH-
关于此燃料电池的下列说法中错误的是
A.X极为负极,Y极为正极
B.工作一段时间后,KOH的物质的量不变
C.在标准状况下通入5.6LO2完全反应,则有1.0mol电子发生转移
D.该电池工作时甲烷一极附近溶液的pH降低
难度: 简单查看答案及解析
-
用惰性电极电解2L硝酸银溶液,当在电路中通过0.1mol电子后,调换正负极,电路中又通过了0.2mol电子,此时溶液pH值为(假设溶液体积不变)是
A.2 B.3 C.1 D.无法确定
难度: 简单查看答案及解析
-
向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A.Va>Vb时:c (CH3COOH) + c (CH3COO-)>c (K+)
B.Va=Vb时:c (CH3COOH) + c (H+)>c (OH-)
C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
难度: 简单查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
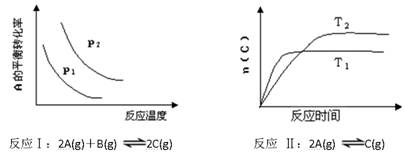
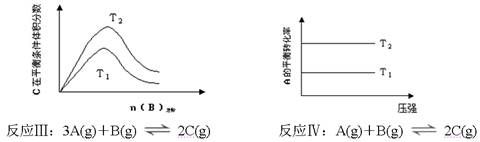
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:ΔH>0,P2>P1
B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T1>T2
D.反应Ⅳ:ΔH<0,T2>T1
难度: 简单查看答案及解析