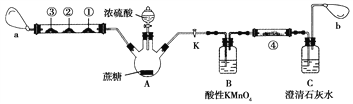
-
在食品生产加工过程中,为保证食物的味道、功能及储存,可以按规定加入一定量的添加剂。下列说法正确的是
A. 中秋月饼包装袋中加的小袋铁粉做干燥剂
B. 卤制品中加入亚硝酸钠,作为抑菌剂
C. 补血口服液中添加维生素C可以促进Fe2+的吸收,维生素C做氧化剂
D. 苏打饼干包装盒中有小袋生石灰作为补钙剂
难度: 简单查看答案及解析
-
已知电解熔融氯化钙可以得到金属钙和氯气。右图中钙及其化合物之间的转化按箭头方向均可一步实现。分析下列说法,其中正确的是
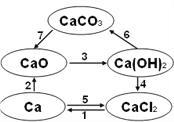
A. CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物
B. 电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应
C. 工业上可利用反应4的原理将氯气通入石灰乳制漂白粉,漂白粉的主要成分是CaCl2
D. 往澄清石灰水中滴加Na2CO3溶液或NaHCO3溶液都可以实现反应6的转化
难度: 中等查看答案及解析
-
关于反应进行方向的判断,以下说法错误的是
A. 高锰酸钾加热分解是一个熵增的过程
B. 能自发进行的化学反应不一定是ΔH<0、ΔS>0
C. ΔH<0的化学反应均是自发反应,ΔS<0的化学反应均不能自发进行
D. 反应2Al2O3(s)+3C(s) = 2Al (s)+ 3CO2(g)在常温下不能自发进行,说明该反应ΔH>0
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是
A. 常温下,4gCH4中含有NA个C—H
B. 1molNa2O2固体中有含有离子总数为4NA
C. 100ml 18.4mol/L的浓硫酸与足量铜在加热条件下充分反应,转移电子1.84NA
D. 10gD2O中含有中子数4NA
难度: 中等查看答案及解析
-
下列事实和解释正确的是
A. 锌与稀盐酸反应,加入NaCl固体后反应速率加快是因为增大了Cl—的浓度
B. 面粉厂内要禁止明火是因为固体表面积大会加快反应速率
C. 5%的H2O2中加入MnO2粉末后分解速率迅速加快是因为MnO2粉末降低了反应的焓变,活化分子数增多,有效碰撞增多
D. 锌与稀硫酸反应滴入CuSO4稀溶液反应速率变慢是因为CuSO4溶液中的水降低了硫酸的浓度
难度: 中等查看答案及解析
-
等温等压下,有质子数相等的CO、N2、C2H2三种气体。下列说法正确的是
A. 质量之比为1∶1∶1 B. 体积之比为14∶14∶13
C. 密度之比为13∶13∶14 D. 原子个数之比为1∶1∶2
难度: 困难查看答案及解析
-
在密闭容器中进行如下反应: aX(g)+bY(g)
cZ(g)。平衡时测得Z的浓度是1 mol/L。保持温度不变,将容器体积压缩为原来的一半,发现Z的浓度上升至1.7mol/L。下列判断正确的是
A. a + b>c B. 平衡常数减小 C. Y的转化率增大 D. X的体积分数增大
难度: 中等查看答案及解析
-
下列关于反应焓变及测定说法正确的是
A. 甲烷的燃烧热为890kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g) +2O2(g) = CO2(g) +2H2O(g) △H=-890kJ/mol
B. 已知:S(s) +O2(g) = SO2(g) △H1和S(g) +O2(g) = SO2(g) △H2。则△H1>△H2
C. 0.1mol的N2和0.3mol的H2在密闭容器中充分反应放热3.8kJ,其热化学方程式可以表示为:3H2(g) +N2(g) = 2NH3(g) △H=-38 kJ/mol
D. 含有2.0gNaOH的稀溶液与足量稀盐酸完全中和放热2.87kJ,则稀醋酸与稀KOH溶液中和反应的热化学方程式:CH3COOH(aq) + KOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ/mol
难度: 中等查看答案及解析
-
下图所示实验方案无法达到预期实验目的的是

A. 用图甲制备Fe(OH)2 B. 用图乙制备少量Cl2
C. 用图丙制备并收集O2 D. 用图丁比较S、C、Si的非金属性强弱
难度: 中等查看答案及解析
-
在一恒温恒容容器内发生反应:C(s)+H2O(g)
CO(g)+H2(g)。下列条件不能确定上述可逆反应已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. 气体密度不再发生变化
C. 生成n mol CO的同时消耗n mol H2O
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
难度: 简单查看答案及解析
-
下列关于碱金属元素(M)的单质及其化合物说法不正确的是
A. 随核电荷数递增单质的熔点依次降低、硬度依次减小
B. 化合物中M的化合价均为+1价
C. 单质在空气中都剧烈反应,生成M2O2
D. 随核电荷数递增单质与水反应的剧烈程度变强
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中可以大量共存的是
A. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B. 加入Al放出H2的溶液中:SO42-、NH4+、Na+、F-
C. pH=7的溶液中:SO32-、Na+、K+、ClO—
D. 无色溶液中:K+、SO42-、Cu2+、Cl—
难度: 中等查看答案及解析
-
H2S在O2中不完全燃烧生成S和H2O。下列说法正确的是
A. 反应中的H2S和O2的总能量高于S和H2O的总能量 B. 微粒半径:O2-> S2-
C. 该反应中反应物的化学能全部转化为热能 D. 非金属性:S > O
难度: 中等查看答案及解析
-
部分短周期元素在元素周期表中位置如右图所示。其中Y、Z的气体单质可以从自然界中用物理方法得到。下列叙述正确的是
A. X的氧化物是酸性氧化物,只能与碱反应
B. X、Y、Z、W的最高正价依次升高
C. 化合物XW4、YZ中各原子均满足最外层8电子稳定结构
D. Y的最简单气态氢化物和W的单质混合可产生白烟
难度: 中等查看答案及解析
-
向溶液X中加入适量的酸性AgNO3溶液,出现浅黄色沉淀。过滤,向滤液中滴加KSCN溶液,溶液变红。下列结论正确的是
A. 浅黄色沉淀可能是S
B. 溶液X中一定含有Fe3+
C. 溶液X的溶质可能是FeBr2
D. 如果浅黄色沉淀是AgI,则溶液X的溶质可能是FeI2或FeI3
难度: 中等查看答案及解析
-
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g)+N2(g)
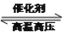 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下表。下列叙述正确的是
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下表。下列叙述正确的是容器编号
起始反应物
达到平衡的时间(min)
平衡时N2的浓度(mol/L)
平衡时气体密度
甲
3molH2、2molN2
t1
c1
ρ1
乙
6molH2、4molN2
5
1.5
ρ2
丙
2molNH3
8
c3
ρ3
A. 2ρ1=ρ2>ρ3
B. 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.05mol/(L·min)
C. c1<c3
D. 2c1<1.5
难度: 困难查看答案及解析
-
下列说法中正确的是
A. 溶液中的溶质粒子能透过滤纸,而胶体中的分散质粒子不能透过滤纸,所以可以用滤纸来分离溶液和胶体
B. 有化学键断裂或化学键形成的过程都是化学变化
C. 焰色反应属于吸热反应
D. 食盐溶液能导电,但食盐溶液不是电解质
难度: 中等查看答案及解析
-
利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g)
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如右图所示。下列结论正确的是

A. 该反应的ΔH>0 B. 平衡常数:K(C)< K(D)
C. 压强:p1>p2 D. 达到平衡时,反应速率:v(A)> v(B)
难度: 困难查看答案及解析