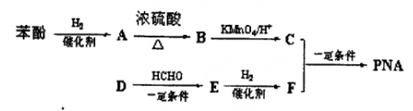
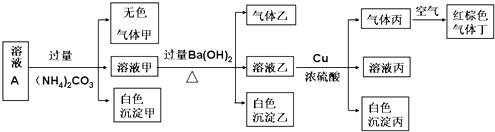
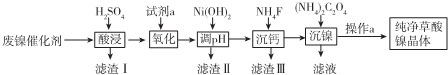
-
下列有关说法中正确的是( )
A.有单质生成的反应,是氧化还原反应
B.焰色反应是元素表现出来的化学性质
C.由两种元素组成,原子个数比为1:1的物质一定是纯净物
D.能与酸反应产物中有盐和水的氧化物不一定是碱性氧化物
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.(NH4)2Fe(SO4)2溶液中:Ba2+、K+、OH-、Br-
B.通入过量SO2气体的溶液中:H+、Ba3+、NO3-、Fe3+
C.c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl-
D.c(I-)=0.1mol/L的溶液中:Na+、Fe3+、ClO-、SO42-
难度: 中等查看答案及解析
-
离子方程式2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O可以表示( )
A.Ca(HCO3)2与NaOH溶液反应 B.Ba(HCO3)2与澄清石灰水反应
C.Ca(HCO3)2与澄清石灰水反应 D.NH4HCO3与澄清石灰水反应
难度: 困难查看答案及解析
-
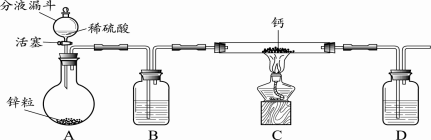
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验,请观察如下图装置、分析实验原理,并判断下列说法和做法,其中不科学的( )
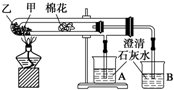
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
难度: 困难查看答案及解析
-
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为xmol
D.反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y-x)mol
难度: 困难查看答案及解析
-
下列实验装置或操作正确的是( )
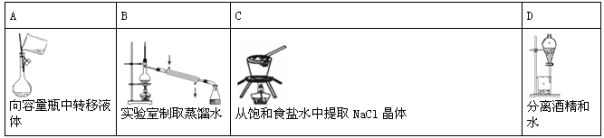
难度: 简单查看答案及解析
-
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2SO4(s)+SO2(g)
[N(CH3)4]2S2O6(s)
下列说法正确的是
A.[N(CH3)4]+中只含共价键
B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性
D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6
难度: 中等查看答案及解析
-
下列离子方程式不正确的是( )
A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+
B.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O
C.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O═Fe(OH)3↓+3HClO
D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
NH4++H++SO42-+Ba2++2OH-═NH3·H2O+BaSO4↓+H2O
难度: 困难查看答案及解析
-
已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-═2RO4n-+3Cl-+5H2O,则RO4n-中R的化合价是
A.+3 B.+4 C.+5 D.+6
难度: 中等查看答案及解析
-
在一定条件下MO3与M-发生反应:MO3-+5M-+6H+=3M2+3H2O,则下列关于M元素的叙述中正确的是
A.M位于元素周期表的第VA族 B.M的氢化物的水溶液呈酸性
C.MO3-中的M元素只能被还原 D.M2在常温常压下一定是气体
难度: 困难查看答案及解析
-
下列制备和收集气体的实验装置合理的是( )
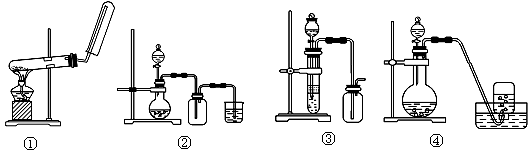
A.装置①:用氯化铵和氢氧化钙制NH3
B.装置②:用铜和稀硝酸制NO
C.装置③:用锌粒和稀硫酸制H2
D.装置④:用双氧水和二氧化锰制O2
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
②常温下21gC3H6和C4H8的混合物中含有的碳原子数为1.5 NA
③2L0.5mol/L亚硫酸溶液中含有的H+为2NA
④3mol单质铁完全转化为Fe3O4,失去8NA个电子
⑤密闭容器中2molNO与1molO2充分反应后,产物的分子数为2NA
⑥将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
A.①③⑤ B.④⑤⑥ C.①②④ D.①⑥
难度: 困难查看答案及解析
-
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是( )
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
难度: 困难查看答案及解析
-
下列实验对应的现象及结论均正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
SO2通入BaCl2溶液,然后滴入稀硝酸
白色沉淀,白色沉淀不溶于稀硝酸
所得沉淀为BaSO3,后转化为BaSO4
B
浓硫酸滴入蔗糖中,并搅拌
得黑色蓬松的固体并有刺激性气味气体
该过程中浓硫酸仅体现吸水性和脱水性
C
向FeCl2溶液中加入足量Na2O2粉末
出现红褐色沉淀和无色气体
FeCl2溶液部分变质
D
向足量含淀粉的FeI2溶液中滴加2滴氯水
溶液变蓝
还原性:I->Fe2+
难度: 中等查看答案及解析
-
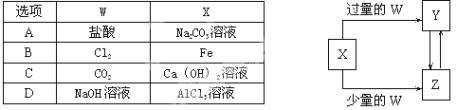
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),则W、X不可能是( )
难度: 中等查看答案及解析
-
关于氮的变化关系图如下:
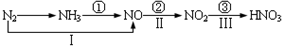
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述反应中只有③属于氮的固定
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
A.原子半径的大小顺序为W>Q>Z>X>Y
B.元素X的气态氢化物与Q的单质可发生置换反应
C.元素X与Y可以形成5种以上的化合物
D.元素Q的最高价氧化物对应的水化物酸性比W的强
难度: 中等查看答案及解析
-
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是( )
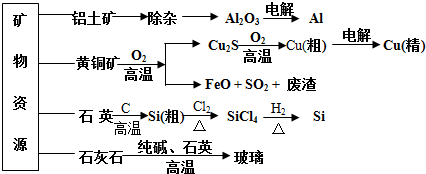
A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
D.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
B.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
难度: 中等查看答案及解析
-
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2
2PbO+2SO2;
③制粗铅:PbO+C
Pb+CO;PbO+CO
Pb+CO2。下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1 molPb共转移2 mol电子
D.将1mol PbS冶炼成Pb理论上至少需要6 g碳
难度: 困难查看答案及解析
-
下列离子组中所给的离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全正确的是( )
选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、S2ˉ、Clˉ、Na+
NaOH溶液
Fe3++3OHˉ═Fe(OH)3↓
B
Na+、Al3+、Clˉ、SO42ˉ
少量KOH溶液
Al3++3OHˉ═Al(OH)3↓
C
H+、Fe2+、SO42ˉ、NO3ˉ
BaCl 2溶液
SO42ˉ+Ba2+═BaSO4↓
D
Na+、K+、ClOˉ、
SO42ˉ
通入少量SO2
2ClOˉ+SO2+H2O═2HClO+SO32ˉ
难度: 困难查看答案及解析