-
【化学——选修3:物质结构与性质】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元索 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一离能至第四电离能分别I1="578" kJ/mol; I2=" l817" kJ/mol;I3="2745" kJ/mol;I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1) TY2是一种常用的溶剂,是__________(填“极性分子”或“非极性分子”),分子中存在________个σ键。
(2)W的最简单氢化物容易液化,理由是__________,.放热419 kJ,该反应的热化学方程式为 __________。
(3)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的第一电离能由大到小的顺序为_________(用元素符号作答)。
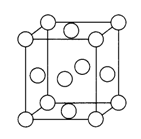
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为___________cm;ZYO4常作电镀液,其中ZYO42-的空间构型是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
-
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
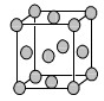
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
-
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
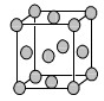
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
-
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
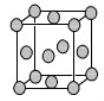
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
-
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
| 元素 | 相关信息 |
| A | 可形成自然界硬度最大的单质 |
| B | 与A元素同周期,核外有三个未成对电子 |
| C | 最外层电子数是其电子层数的3倍 |
| D | 第一电离能至第四电离能分别是I1=578KJ/mol,I2=1817KJ/mol,I3=2745KJ/mol, I4=11575KJ/mol |
| E | 常温常压下,E的单质是固体,其氧化物是形成酸雨的主要物质 |
| F | F的一种同位素的质量数为63,中子数为34 |
(1)A、B、C元素的第一电离能由大到小的顺序为 (用元素符号表示)。F的基态原子核外电子排布式为 。
(2)AE2是一种常用的溶剂,是 (填“极性”或“非极性”)分子,分子中σ键与π键个数比为 。
(3)写出D与NaOH溶液反应的离 子方程式 。DB形成的晶体与金刚石类似,它属于 晶体。B的最简单氢化物容易液化,理由是
子方程式 。DB形成的晶体与金刚石类似,它属于 晶体。B的最简单氢化物容易液化,理由是

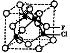
(4)已知F的晶体结构如图所示,又知F的密度为9.00g·cm-3,则晶胞边长为 ;FEC4常作电镀液,其中EC42-的空间构型是 ,其中E原子的杂化轨道类型是 。
(5)F的一种氯化物晶胞体结构如图所示,该氯化物的化学式是 。
-
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ·mol-1,I2=1817kJ·mol-1,I3=2745kJ·mol-1,I4=11575kJ·mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是__(填“极性分子”或“非极性分子”),分子中存在 ___个 键。W的最简单氢化物容易液化,理由是___。
键。W的最简单氢化物容易液化,理由是___。
(2)在25℃、101kPa下,已知13.5g的X固体单质在O2中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为__。
(3)基态Y原子中,电子占据的最高能层符号为__;该能层具有的原子轨道数为___、电子数为___,Y、氧、W元素的电负性由大到小的顺序为___(用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g·cm-3,则晶胞边长为___;
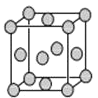
ZYO4常作电镀液,其中YO42-的空间构型是__,其中Y原子的杂化轨道类型是___,Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2(超氧酸 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是__。
不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是__。
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1molZ参加反应有1mol电子发生转移
-
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元索 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一离能至第四电离能分别I1=578 kJ/mol; I2= l817 kJ/mol; I3=2745 kJ/mol;I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2的结构式是__________是__________(填“极性分子”或“非极性分子”),1mol该分子中存在________个σ键。
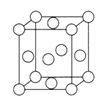
(2)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的电负性由大到小的顺序为_________(用元素符号作答)。
(3)已知Z的晶胞结构如图所示,又知Z的密度为a g/cm3,则Z 的半径为___________pm;ZYO4常作电镀液,其中YO42-的等电子体是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是___________。
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1 mol Z参加反应有1 mol电子发生转移
-
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 =578 kJ/mol,I2=1 817 kJ/mol,I3= 2 745 kJ/mol,I4 =11 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 ,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。
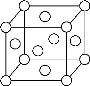
-
(15分) A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 =578 kJ/mol,I2=1 817 kJ/mol,I3= 2 745 kJ/mol,I4 =11 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。

-
(1 4分)X.Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如下表
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | 基态原子核外p能级电子总数比s能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球生物的“保护伞” |
| W | 含量位居地壳中金属元素的第二位 |
回答下列问题:
(1)Z位于元素周期表第 周期第 族,W的基态原子核外电子排布式为 。
(2)Y的第一电离能比Z (填“大”或者“小”);由X、Y、Z三种元素组成的一种盐的化学式为 。
(3)写出W元素的单质与X2Z在高温条件下反应的化学方程式 。
(4)在500℃、30MPa下,将1mol X2 与足量的Y2 置于密闭容器中充分反应生成YX3,当X2 的转化率为25%时,放出热量为7.7kJ,则该反应的热化学方程式为: 。









