-
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是( )
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染
难度: 简单查看答案及解析
-
下列有关化学用语或名称表达正确的是( )
A.亚硫酸的电离方程式:H2SO3
2H++SO
B.乙炔的分子结构模型示意图:
C.H2O2的电子式:
D.
的名称3-甲基-1-丁醇
难度: 简单查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是( )
A.SO2具有氧化性,可用于漂白纸浆
B.炭具有还原性,一定条件下能将二氧化硅还原为硅
C.BaCO3、BaSO4都难溶于水,均可用做钡餐
D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe3+、Cl-、NO
、K+
B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO
、NO
C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO
、ClO-
D.c(SO
)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
难度: 简单查看答案及解析
-

图1 图2 图3 图4
A. 用图1所示装置制取干燥的氨气
B. 用图2所示装置除去碳酸氢钠固体中的少量碳酸钠
C. 用图3所示装置将溶液定容到100 mL
D. 用图4所示装置分离出溴苯
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA
B.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA
C.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
D.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
难度: 简单查看答案及解析
-
下表各组物质中,物质之间不可能实现如图所示转化的是( )
选项
X
Y
Z
M
A
NH3
NO
NO2
O2
B
Cl2
FeCl3
FeCl2
Fe
C
Al
Al(OH)3
NaAlO2
NaOH
D
NaOH
Na2CO3
NaHCO3
CO2
难度: 中等查看答案及解析
-
下列说法中用离子方程式表达正确的是( )
A.用惰性电极电解氯化钠溶液:2Cl-+2H+
H2↑+Cl2↑
B.向NaAlO2溶液中通入过量CO2:2AlO
+CO2+3H2O=2Al(OH)3 ↓+CO
C.Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO
+4H+===Fe3++NO↑+2H2O
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO
+Ca2++OH-=== CaCO3↓+H2O
难度: 简单查看答案及解析
-
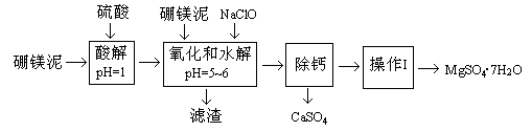
下列说法不正确的是( )
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体
C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
D.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的
难度: 中等查看答案及解析
-
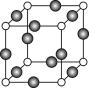
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
难度: 中等查看答案及解析
-
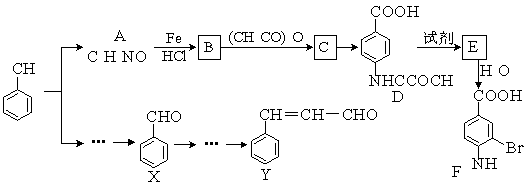
某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
X Z
下列有关叙述中不正确的是( )
A.Z结构中有4个手性碳原子
B.Y的分子式为C9H8O3
C.1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH
D.Z与浓溴水既能发生取代反应又能发生加成反应
难度: 简单查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是 ( )
X
Y
Z
W
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
难度: 简单查看答案及解析
-
某课外活动小组的同学从某地颗粒采集器中获得雾霾颗粒样品,然后用蒸馏水浸取。在探究雾霾颗粒可溶性成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.向浸取液中滴入AgNO3溶液有白色沉淀产生,说明雾霾中一定含有Cl-
B.向浸取液中滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42-
C.向浸取液中加入Cu和浓H2SO4,试管口有红棕色气体产生,说明雾霾中可能含有NO3-[源
D.向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有NH4+
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)==C(石墨);ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH=—53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
难度: 简单查看答案及解析
-
a g Mg、Al合金完全溶解在C1 mol·L-1、V1L HCl溶液中,产生b g H2。再向反应后的溶液中加入C2 mol·L-1、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是 ( )
A.铝为 (24b-a)/9 mol B.C1=C2V2/V1
C.d=a+17b D.与金属反应后剩余盐酸为(C1V1-b)mol
难度: 困难查看答案及解析

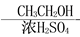 CH3COOCH2CH3
CH3COOCH2CH3

 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN