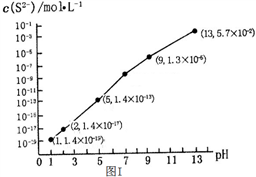
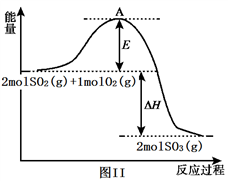
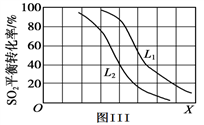
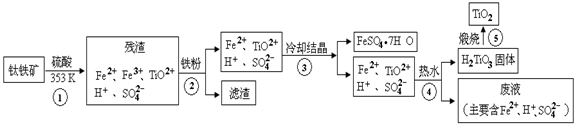
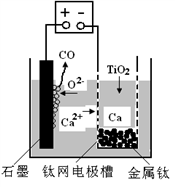
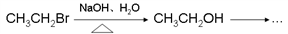-
下列有关说法正确的是
A. 明矾既可用作净水剂,也可用作消毒剂
B. 小苏打、氢氧化铝都可用于治疗胃酸过多
C. 煤的干馏和石油的分馏都属于化学变化
D. 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体。
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 将1 molNH3通入水中得到1L溶液,则NH4+与NH3·H2O粒子总数为NA
B. 1.2 g NaHSO4晶体中含有离子总数为0.03 NA
C. 标准状况下,2.24 L SO3含有的分子数为0.1 NA
D. 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 正丁烷与2-甲基丁烷互为同分异构体
B. 聚乙烯能使溴的四氯化碳溶液褪色,发生的反应是加成反应
C. 苯不能使酸性高锰酸钾溶液褪色,但在FeBr3存在下能与液溴发生取代反应
D. 除去乙酸乙酯中残留的乙酸,有效的处理方法是水洗后分液
难度: 简单查看答案及解析
-
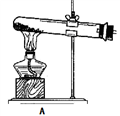
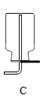
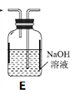
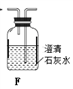
下图所示实验中,能够达到目的的是
A
B
C
D




验证: 溶解性AgCl>AgBr>Ag2S
验证:非金属性Cl>C>Si
验证: 铁粉与水蒸气反应产生的氢气
验证:热稳定性
Na2CO3 >NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族,m、p、n分别是元素A、B、C的单质, D的单质可与热水发生置换反应;x、y、z是由A、B、C组成的二元化合物,其中y、z是气体,且z可用于配制碳酸饮料。它们之间有如下转化关系,
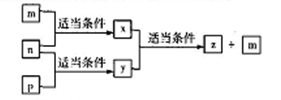
下列说法正确的是
A. D的单质起火燃烧时可用z作灭火剂
B. 元素的非金属性:C >A >B
C. B、C与A形成化合物的沸点:C >B
D. 原子半径:D >B >C >A
难度: 困难查看答案及解析
-
图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
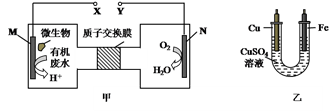
A. N为正极,铁电极应与Y相连接
B. M电极反应式: CO(NH2)2+H2O-6e- = CO2↑+N2↑+6H+
C. 当N电极消耗0.25 mol气体时,则铁电极增重16 g
D. H十透过质子交换膜由右向左移动
难度: 中等查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3 A(g)+2B(g)
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为 5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
难度: 中等查看答案及解析