-
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
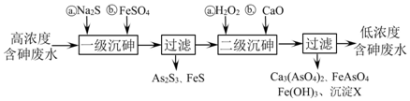
已知:①As2S3与过量的S2−存在以下反应:As2S3(s)+3S2−(aq)
2
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_______________________。
(2)“一级沉砷”中FeSO4的作用是_____________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6 g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1 g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为___________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5 g·kg−1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是_________________________。
难度: 中等查看答案及解析
-
锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
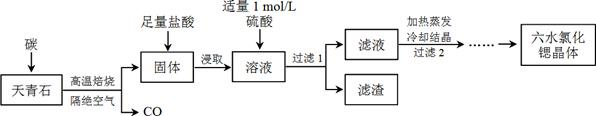
(1)工业上天青石焙烧前先研磨粉碎,其目的是_______________________________。
(2)工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:__________________________。
(3)加入硫酸的目的是____________________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L[注:此时滤液中Ba2+浓度为1×10−5 mol/L,Ksp(BaSO4)=1.1×10−10,Ksp(SrSO4)=3.3×10−7]。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10−2 mol的AgNO3溶液(溶液中除Cl−外,不含其它与Ag+反应的离子),待Cl−完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是____________。
难度: 中等查看答案及解析
-
用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、
、F−和
等。如图是综合利用该酸洗废液的工艺流程:
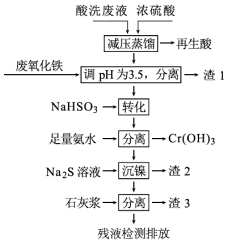
已知:
①金属离子开始沉淀和沉淀完全时的pH:
Fe3+
Ni2+
Cr3+
开始沉淀
1.5
6.7
4.0
沉淀完全
3.4
9.5
6.9
②Ni2+与足量氨水的反应为:Ni2++6NH3
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为_________________________________。
(2)滤渣1的主要成分为____________。
(3)请写出“转化”时NaHSO3与
发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为______________________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和________。
(6)经检测,最后的残液中c(Ca2+)=0.001 mol·L−1,则残液中F-浓度为_______mg·L−1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10−11,国家排放标准要求氟离子浓度小于10 mg·L−1]。
难度: 中等查看答案及解析
-
金属钛(Ti)因硬度大、熔点高、常温时耐酸碱腐蚀而被广泛应用。以钛铁矿(主要成分是FeTiO3,钛酸亚铁)为主要原料冶炼金属钛的工艺流程如图所示:

请回答下列问题:
(1)钛铁矿在酸浸前需进行粉碎处理,原因是 。
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
(3)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 。
(4)在溶液Ⅱ中加水并加热的目的是 。
(5)上述冶炼金属钛的过程中,可回收利用的物质是 。
(6)上述流程制得的金属钛中混有少量杂质,可加入 溶解除去。
(7)若钛铁矿中钛的含量为a%,整个流程钛的损耗率为b%,欲制造1 t金属钛,需要钛铁矿的质量为_____________t(用含a、b的代数式表示)。
难度: 中等查看答案及解析
-
KClO3晶体是一种常见的氧化剂,生产工艺如图所示:
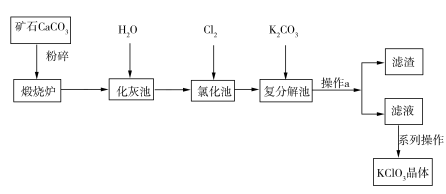
请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________。该反应中,氧化剂与还原剂的物质的量之比为________。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________。
(4)“复分解池”反应中,发生反应的离子方程式为_________________。
(5)实验室制取KClO3可通过反应:3Cl2+6KOH
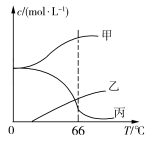
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________________。(不考虑Cl2的挥发)
(6)甲同学为测定制取的KClO3样品中
的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L−1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中
的质量分数为______________。(已知:
+6Fe2++14H+
2Cr3++6Fe3++7H2O,
可被Fe2+还原为Cl−。)
难度: 中等查看答案及解析
-
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量
、Fe3+、
、Cl−。为除去杂质离子,部分操作流程如图:
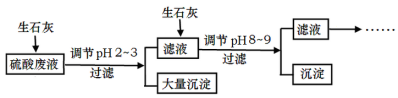
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的密度为4.9g•L−1,则该溶液中的pH约为 。
(2)
在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(
)恰好是NH4Cl溶液中c(
)的2倍,则c[(NH4)2SO4]___________c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中
(填“增大”“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],提纯CaSO4•2H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25℃,H3AsO4电离常数为K1=5.6×10−3,K2=1.7×10−7,K3=4.0×10−12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为: 。
③已知:
+2I−+2H+
+I2+H2O,SO2+I2+2H2O
+2I−+4H+。上述两个反应中还原性最强的微粒是 。
难度: 中等查看答案及解析