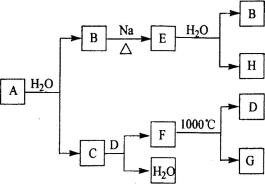
-
下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4- + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
难度: 中等查看答案及解析
-
把500ml含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀:另取一份加入含b mol硝酸银的溶液,恰好使卤离子完全沉淀,则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol·L-1 B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1 D.10(b-2a) mol·L-1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3—、SO42—、Na+
B.由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl—、HCO3—
C.c(H+)/c(OH—)=1012的溶液中:NH4+、Al3+、NO3—、Cl—
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO—、SO42—、SCN—
难度: 中等查看答案及解析
-
能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
难度: 中等查看答案及解析
-
表示阿伏加德罗常数,下列判断正确的是
A.在16
中含有
个氧原子
B.16g
中含有4
个C-H键
C.1mol Cu和足量稀硝酸反应产生
个NO分子
D.含
个
的
溶解于1L水中,
的物质的量浓度为1 mol·L-1
难度: 中等查看答案及解析
-
在一定的温度、压强下,向100mLCH4和Ar的混合气体中通入400mLO2,点燃使其完全反应,最后在相同条件下得到干燥气体460mL,则反应前混合气体中CH4和Ar的物质的量之比为 ( )
A.1:4 B. 1:3 C. 1:2 D. 1:1
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种易溶于水的物质,分别由
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入
溶液有不溶于稀
的白色沉淀生成,下列结论不正确的是
A.甲溶液含有
B.乙溶液含有
C.丙溶液含有
D.丁溶液含有
难度: 中等查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 ( )
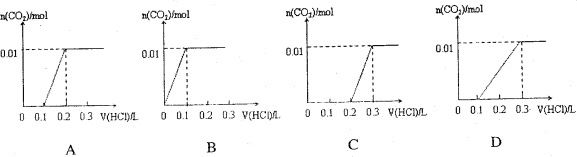
难度: 中等查看答案及解析
-
下列叙述正确的是
A.铝制容器可盛 装热的浓H2SO4 B.AgI胶体在电场中自由运动
C.K与水反应比Li与水反应剧烈 D.红磷在过量Cl2中燃烧生成PCl3
难度: 中等查看答案及解析
-
除去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤 B.KNO3晶体(NaCl),蒸馏水,结晶
C.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 D.C2H5OH(CH3COOH),加足量CaO,蒸馏
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
短周期元素W 、X、 Y、 Z的原子序数依次增大,且W 、X、 Y+、 Z的最外层电子数与其电子层数的比值依次为2 、3、 4、 2(不考虑零族元素)。下列关于这些元素的叙述错误的是
A.X和其他三种元素均可形成至少2种二元化合物
B.W和X、Z两种元素分别形成的二元化合物中,均有直线形分子
C.W 、X和Y三种元素可以形成碱性化合物
D.Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
A.X、Y元素的金属性 X<Y
B.一定条件下, Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 中等查看答案及解析
-
下列判断正确的是
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
难度: 中等查看答案及解析
-
下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是 ( )
A.取a克混合物充分加热,剩余b克固体
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰直接吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
难度: 中等查看答案及解析