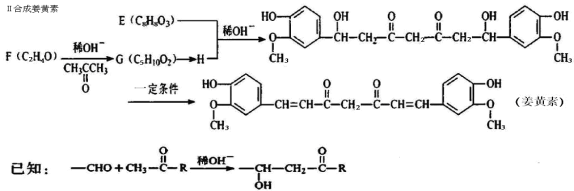
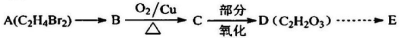-
下列应用中,主要利用物质氧化性的是
A.用烟道气中和碱性废水 B.重铬酸钾用于酒驾检查
C.用苯酚制造酚醛树脂 D.金属加工前用硫酸酸洗
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol Na2O2与水反应转移电子数目为0.1 NA
B.标况下,2. 24 L Cl2含孤电子对的数目为0.2NA
C.pH =2的H2SO4洛液中含H+的数目为0.1 NA
D.在l0g质量分数为17%的氨水中,含有H的数目为0.3 NA
难度: 中等查看答案及解析
-
下列离子方程式不能解释对应实验事实的是
A.向小苏打溶液滴加少量盐酸:HC03- +H+= H2O+CO2↑
B.用漂白液吸收过量SO2: SO2+H2O+ClO-=2H+ +SO42- +Cl-
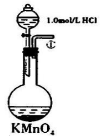
C.将少量乙烯气体通入酸性KMnO4溶液:CH2 =CH2 +4H++MnO4—= C2O42-+Mn2++ 4H2O
D.将铜丝插入稀硝酸中:3Cu+8H++2N03一 =3Cu2++ 2NO↑ + 4H2O
难度: 中等查看答案及解析
-
如图为元素周期表的一部分,W、X、Y、Z均为短周期主族元素。下列分析—定正确的是
W
X
Y
Z
A.Y的气态氢化物最稳定
B.Z的单核阴离子还原性最强
C.x单质常温下化学性质活泼
D.Y的原子序数比W大7
难度: 中等查看答案及解析
-
下列实验装置设计不恰当的是
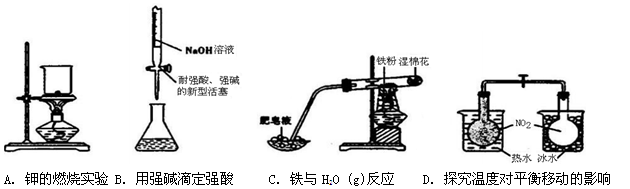
难度: 中等查看答案及解析
-
常温下,向10 mL o.1 mol/L的HR溶液中逐滴滴人0.l mol/L的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
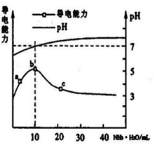
A.a~b点导电能力增强说明HR为弱酸
B.b点溶液pH =7说明NH4R没有水解 。
C.c点溶液存在c( NH4+)>c( R-)、c(OH-)>c(H+)
D.b~e任意点溶液均有c(H+)×c(OH-)= Kw =l. 0×l0-14
难度: 困难查看答案及解析
-
工业上用DME法以H2和CO为原料生产甲醚(CH3 OCH3)。其原理是在同一容器中发生如下两个连续反应:
①2H2(g) +CO(g)
CH3OH(g)
②2CH3OH(g)
CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是
温度(℃)
平衡态
260
270
280
290
300
310
320
CO转化率(%)
92
87
82
80
72
65
62
CH3OCH3产率(%)
33
45
77
79
62
58
52
A.反应①、②均为吸热反应
B.290℃时反应②平衡常数值达到最大
C.平衡时,反应①与②中CH3OH的消耗速率一定相等
D.增大压强能增大CH3OCH3产率
难度: 困难查看答案及解析