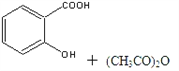
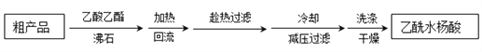
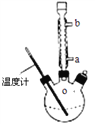
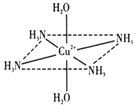
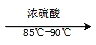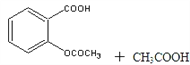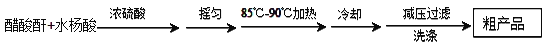-
下列说法正确的是( )
A. 处于最低能量的原子叫基态原子
B. 3p2表示3p能级有2个轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 中等查看答案及解析
-
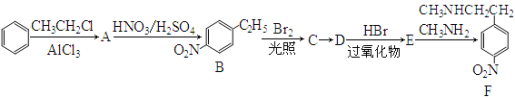
下列实验操作中正确的是
A. 制取溴苯:将铁屑、溴水、苯混合加热
B. 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
C. 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
D. 通过向溴水中加入乙醇来萃取溴水中的溴
难度: 中等查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A. CH4和NH4+是等电子体,键角均为60°
B. NO3―和CO32―是等电子体,均为平面正三角形结构
C. H3O+和PCl3是等电子体,均为三角锥形结构
D. B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 中等查看答案及解析
-
“地沟油”是用饭店的泔水及垃圾猪肉等加工而成的“食用油”。下列有关说法中正确的是( )
A. “地沟油”的主要成分是蛋白质,还含有较多的微量元素
B. “地沟油”外观与普通食用油一样,经过处理的“地沟油”具有固定的熔沸点
C. “地沟油”在加入消泡剂后,消除了其对人体健康的影响
D. “地沟油”可用于生产生物柴油
难度: 中等查看答案及解析
-
现有淀粉溶液、鸡蛋清、葡萄糖溶液,区别它们时,下列试剂和对应现象依次是( )
试剂:①新制的Cu(OH)2 ②碘水 ③浓硝酸
现象:a.变蓝色 b.红色沉淀 c.变黄色
A. ②—a、①—c、③—b B. ③—a、②—c、①—b
C. ②—a、③—c、①—b D. ②—c、③—a、①—b
难度: 简单查看答案及解析
-
网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除
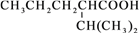 外,还有( )
外,还有( )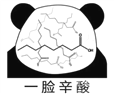
A. 7种 B. 11种 C. 14种 D. 17种
难度: 困难查看答案及解析
-
某羧酸酯的分子式为C16H14O4,1 mol该酯完全水解可得到2 mol羧酸和1 mol乙二醇(HOCH2—CH2OH),该羧酸的分子式为( )
A. C7H6O2 B. C8H8O4 C. C14H12O2 D. C6H6O4
难度: 简单查看答案及解析
-
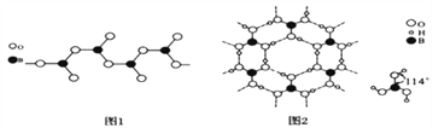
有机物X是合成二氢荆芥内酯的重要原料,其结构简式为
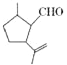 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )A. 先加酸性高锰酸钾溶液,后加银氨溶液,加热
B. 先加溴水,后加酸性高锰酸钾溶液
C. 先加银氨溶液,加热,再加入溴水
D. 先加入新制氢氧化铜悬浊液,加热,取清液酸化后再加溴水
难度: 中等查看答案及解析
-
绿原酸的结构简式如图,下列有关绿原酸的说法错误的是( )
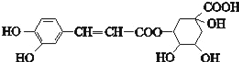
A. 分子式为C16H18O9 B. 能与NaHCO3反应
C. 能发生取代反应、氧化反应和消去反应 D. 1 mol绿原酸最多与6 mol Br2反应
难度: 中等查看答案及解析
-
分子式为C6H10O3并能使新制Cu(OH)2悬浊液溶解,继续加热会出现砖红色沉淀的有机物有(不含立体异构)( )
A. 8种 B. 9种 C. 12种 D. 13种
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A. K+的结构示意图:
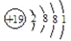 B. 基态氮原子的电子排布图
B. 基态氮原子的电子排布图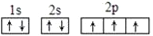
C. 水的电子式:
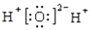 D. 基态铬原子(24Cr)的价电子排布式:3d44s2
D. 基态铬原子(24Cr)的价电子排布式:3d44s2难度: 简单查看答案及解析
-
根据表中信息,下列叙述正确的是( )
短周期元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.089
0.104
0.066
主要化合价
+2
+3
+2
+6、﹣2
﹣2
A. 氢化物的热稳定性:H2T<H2R
B. 单质与稀盐酸反应的速率:L<Q
C. 离子半径:R2﹣<L2+
D. M与T形成的化合物既能与强酸反应,又能与强碱反应
难度: 简单查看答案及解析
-
A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A 的正价与B的负价绝对值一定相等;⑥A的电负性小于B的电负性;⑦A的第一电离能大于B的第一电离能.其中正确的组合是( )
A. ③④⑥ B. ①②⑦ C. ③⑤ D. ③④⑤⑥⑦
难度: 中等查看答案及解析
-
不能说明X的电负性比Y的大的是( )
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X单质可以把Y从其氢化物中置换出来
难度: 中等查看答案及解析
-
下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②含有金属阳离子的晶体一定是离子晶体;
③共价键可决定分子晶体的熔、沸点;
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小;
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列;
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定;
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6
A. ①②③ B. ②③④ C. ④⑤⑥ D. ②③⑦
难度: 中等查看答案及解析
-
下列有关金属的说法正确的是( )
A. 金属原子的核外电子在金属晶体中都是自由电子
B. 金属导电的实质是金属阳离子在外电场作用下的定向移动
C. 金属原子在化学变化中失去的电子数越多,其还原性越强
D. 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2
难度: 中等查看答案及解析
-
某原子晶体的基本结构单元是正二十面体,每个原子与另外五个原子相连,每个面均是正三角形,请分析该晶体的棱数和定点数( )
A. 60、12 B. 12、30 C. 30、12 D. 10、30
难度: 中等查看答案及解析
-
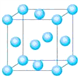
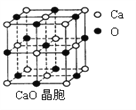
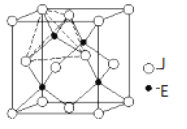
有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
难度: 简单查看答案及解析