-
为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行如下了实验。
利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量。
实验装置如图所示。
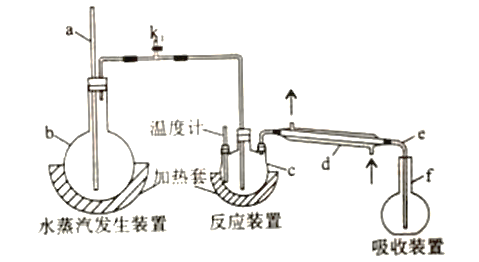
(1)a的作用是____________,仪器d的名称是________________ 。
(2)检查装置气密性:____________(填操作),关闭k,微热c,导管e末端有气泡冒出;停止加热,导管e 内有一段稳定的水柱,说明装置气密性良好。
(3)c中加入一定体积高氯酸和m g氟化稀土样品,Z 中盛有滴加酚酞的NaOH 溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质可代替高氯酸的是_________(填序号)。
A.硝酸 B.盐酸 C.硫酸 D.磷酸
②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成。若有SiF4生成,实验结果将__________ (填“偏 高”“ 偏 低”或“不受影 响” )。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是______________。
(4)向馏出液中加入V1mL c1mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2mol·L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2ml,则氟化稀土样品中氟的质量分数为______________。
(5)用样品进行实验前,需要用0.084 g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是___________。
-
利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)回收CoO的工艺流程如下:
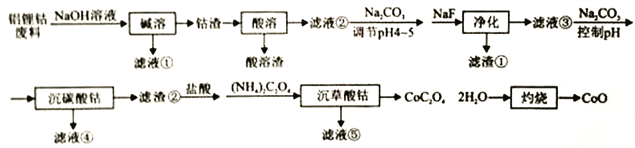
回答下列问题:
(1)“碱溶”的目的是:________________。
(2)不同浸出剂“酸溶”实验结果见下表,根据数据和物质性质应选择的浸出剂是___________(填序号),理由是__________ (用Co3O4参与反应的离子方程式表示)。
| 浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% |
| Co | Al |
| (a)HCI | 80.84 | 5.68 | 98.4 |
| (b)H2SO4 | 65.0 | 6.22 | 72.3 |
| (c)H2SO4+ Na2S2O3 | 84.91 | 5.96 | 98.0 |
(3)“净化”产生的滤渣为____________(填化学式),滤液③中c(F-)=4.0×10-3mol·L-1,则“净化”后残余c(Li+)=___________。LiF与Li2CO3的Ksp分别为1.8×10-3、1.7×10-3。
(4)若滤液④中含Co2+为5.9×10-2g·L-1,“沉碳酸钴"应控制pH不高于___________。Co(OH)2的Ksp为1.0×10-15。
(5)“沉碳酸钴“→“沉草酸钻”的目的是___________。
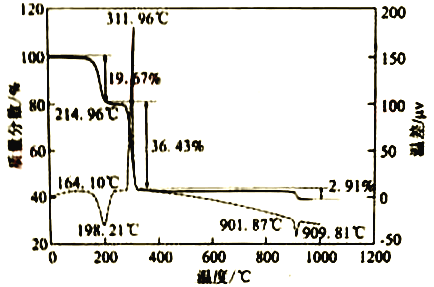
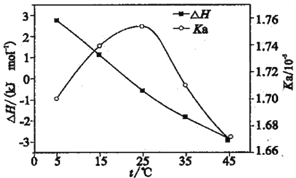
(6)CaC2O4·H2O在空气氛围中的热重曲线如下图。在311.96℃附近有个很强的放热峰的原因是______。900℃发生反应的化学方程式为___________。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO2(g)+ H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
iii. CH3OH(g) CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
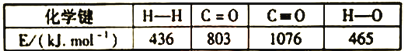
由此计算△H2=__________kJ·mol-1。已知△H3=99kJ·mol-1,则△H1=_________kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。
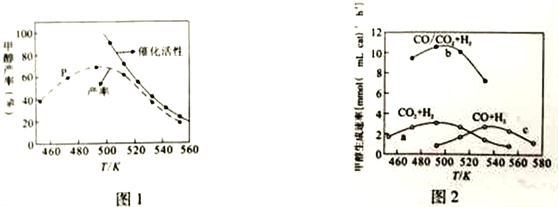
①温度为470K时,图中P点_______ (填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是_______;490K之后,甲醇产率下降的原因是_______。
②一定能提高甲醇产率的措施是______________。
A.增大压强 B,升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c判断合成甲醇的反应机理是_________ (填“I”或“II")。

②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因_________。
-
一种可用于生物医学领域的平面五角星形钯(Ⅱ)配位络离子结构如右图,已知钯是原子序数为46的过渡元素。
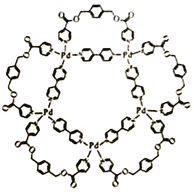
回答下列问题。
(1)钯(Ⅱ)配位络离子中的第二周期元素,其第一电离能从大到小的顺序为_____________(填元素符号)。
(2)钯(Ⅱ)配位络离子中含有的作用力类型为___________ (填序号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(3)钯(Ⅱ)配位络离子中基态钯离子价电子排布式为____________,钯离子的杂化轨道类型_______(填“是”或“不是”)sp3,理由是___________。
(4)钯(Ⅱ)配位络离子中能与氢氧化钠溶液反应的配体,其分子式为__________,每1mol该配体与氢氧化钠反应时断裂的共价键类型及数目为____________。
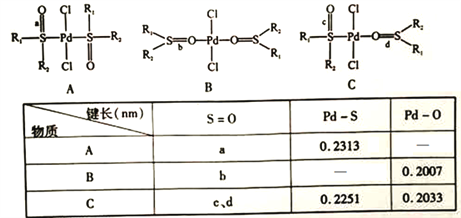
(5)钯易与亚砜(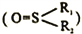 )生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:
)生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:
①亚砜的晶体类型为___________________。
②配位键稳定性:Pd-s>Pd-O,其证据为______________ (用上表数据说明)。
③三种配合物中S=O键长不同,其数值最小的是______________(填“a"“b"“c”或“d")
-
杨梅醛是常用的水果型食用香精,合成路线如下。
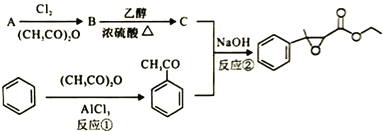
(1)杨梅醛的分子式为______________。
(2)与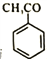 互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
(3)反应①的反应类型为___________,该反应的另一产物在合成中可循环利用,其结构简式为___________。
(4)已知反应②的另一产物不含碳原子,B中含有的官能团为__________ (填名称),C的结构简式为___________。
(5)写出反应②的化学方程式___________。
(6)写出两种符合以下条件的杨梅醛的同分异构体的结构简式___________。
i.与FeCl3发生显色反应且能发生银镜反应
ⅱ.有三个互为间位的取代基且每个取代基含一个官能团
ⅲ含有-CH3和-CHO基团各两个
(7)根据上述合成路线写出乙酐和A为原料制备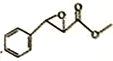 的合成路线____________(其试剂任选)。
的合成路线____________(其试剂任选)。
(b)的新方法。下列说法不正确的是
 。下列说法不正确的是
。下列说法不正确的是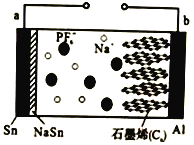







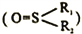 )生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:
)生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:

 互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。 的合成路线____________(其试剂任选)。
的合成路线____________(其试剂任选)。