-
化学与生产、生活、社会密切相关,下列有关说法中不正确的是
A.央视曝光“毒胶囊”事件,主要是其中重金属含量超标,重金属对人体危害主要是使蛋白质变性
B.大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同
C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物
D.针对H7N9流感的扩散情况,常选用含氯消毒剂、双氧水等物质进行消毒预防
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.HClO的电子式:
B.中子数为10的氧原子:
C.硝基苯的结构简式:
D.CH4分子的球棍模型:
难度: 简单查看答案及解析
-
下列各组离子中,在给定条件下能够大量共存的是
A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32-
B.无色溶液中:Mg2+、MnO4-、SO42-、K+
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(ClO-)= 1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42-
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,Y与M形成的气态化合物在标况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.由X、Y、Z、M四种元素形成的化合物一定有共价键
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质一定是原子晶体
D.XZ2、X2M2、W2Z2均为直线型的共价化合物
难度: 中等查看答案及解析
-
下列关于有机化合物的结构、性质的叙述正确的是
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH稀溶液反应,因为分子中均含有官能团“—OH ”
难度: 中等查看答案及解析
-
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是
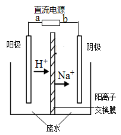
A.若以CH4—空气燃料电池为直流电源,燃料电池的b极应通入空气
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极反应CH3CHO -2e- + 2H+== CH3COOH + H2O
D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
难度: 中等查看答案及解析
-
下列实验装置设计正确、且能达到目的的是
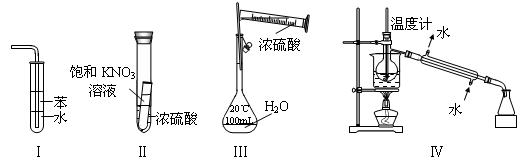
A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
难度: 简单查看答案及解析
-
2013年6月20日,中国首次太空授课活动成功举行,神舟十号航天员王亚平在天宫一号展示了失重环境下的物理现象。若在天宫一号中进行以下实验,其中最难完成的是
A.将金粉和铜粉混合 B.将牛奶加入水中混合
C.蒸发食盐水制取食盐晶体 D.用漏斗、滤纸过滤除去水中的泥沙
难度: 简单查看答案及解析
-
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
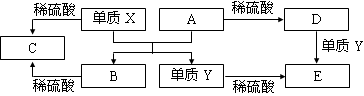
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
难度: 中等查看答案及解析
-
下列离子反应方程式正确的是
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42―
Cu2++ SO2↑+ 2H2O
B.电解饱和食盐水:2Cl- +2H+
H2↑+C12↑
C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2 = 2Fe3++2H2O
难度: 中等查看答案及解析
-
关于下列各图的叙述正确的是
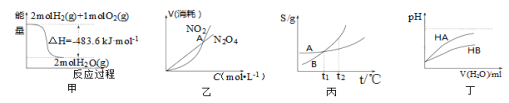
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
难度: 中等查看答案及解析
-
下列说法正确的是
A.按系统命名法,化合物
的名称是2,5,5—三甲基—3—乙基庚烷
B.将
与NaOH的醇溶液共热可制备CH3—CH═CH2
C.向柠檬醛
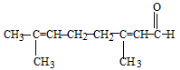 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基D.
、
、
三种氨基酸脱水,最多可生成6种二肽。
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序列
参加反应的物质
生成物
①
KMnO4 、H2O2 、H2SO4
K2SO4 、MnSO4 ……
②
Cl2 、FeBr2
FeCl3 、FeBr3
③
MnO4- ……
Cl2 、Mn2+ ……
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序MnO4- > Cl2 > Fe3+ > Br2
难度: 困难查看答案及解析
-
下列实验操作、现象和原因解释不合理的是
选项
实验操作
实验现象
原因解释
A.
将一片较簿的铝片放在酒精灯火焰上灼烧
铝片慢慢熔化呈液滴状
铝表面的氧化膜致密且熔点很高,阻碍铝与氧气的接触,同时铝的熔点较低熔化了
B.
将等表面积的镁条、铝片(均除去氧化膜)分别放入装有等浓度、等体积盐酸的两支试管中
都产生气泡,镁条表面产生气泡更快
镁的金属性比铝的金属性强,镁更易失去电子,所以反应更快
C.
在打磨过的铁片上先滴一滴饱和食盐水,再滴一滴酚酞
液滴的外圈先出现红色
铁片不纯含有碳元素,铁、碳与食盐水形成原电池,溶液外圈发生吸氧腐蚀,导致c(OH-)增大,溶液呈碱性
D.
取少量淀粉加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,加热至沸腾
未见砖红色沉淀生成
淀粉水解后没有葡萄糖生成
难度: 简单查看答案及解析
-
S2Cl2在合成橡胶、硬水软化等方面有着重要应用。将Cl2通入熔融的硫磺可制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊。有关叙述正确的是
A.在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质
B.Cl2与硫磺的反应中,S2Cl2只是氧化产物
C.在常温常压下,硫磺是原子晶体,S2Cl2是分子晶体
D.S2Cl2与水反应时,既体现氧化性又体现还原性
难度: 中等查看答案及解析
-
下列说法正确的是
A.增大压强任何反应的反应速率都一定增大
B.已知H2CO3的电离常数分别为Ka1=4.3×10-7、Ka2=5.61×10-11,苯酚的电离常数Ka=1.1×10-10。苯酚钠溶液中通入少量CO2时的化学方程式为:
C.pH=2的盐酸和pH=4的硫酸溶液等体积混合后溶液的pH=3
D.在滴有酚酞的氢氧化钠溶液中逐滴滴入盐酸至红色恰好消失,此时溶液的pH=7
难度: 中等查看答案及解析
-
下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是


A.甲中铜片作阴极,K+向铜片电极移动
B.乙中正极发生的电极反应为CO2+6e-+6H+
CH3OH+H2O
C.乙中H2SO4的作用是增强溶液的导电性
D.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2
难度: 困难查看答案及解析
-
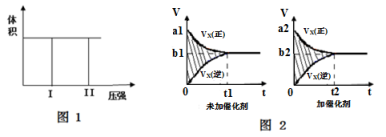
如图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
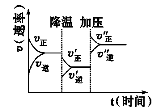
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应
D.A、B、C、D均为气体
难度: 中等查看答案及解析
-
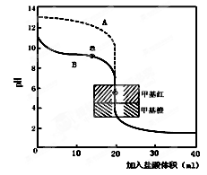
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
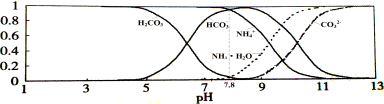
A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
难度: 困难查看答案及解析
-
某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份100mL溶液进行如下实验:已知HNO2是一种不稳定的弱酸,易分解生成NO2和NO,AgNO2是一种不溶于水的白色沉淀。
①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol·L-1的硫酸溶液恰好完全吸收,酸也不剩余。根据上述实验,以下推测不正确的是
A.原溶液一定不存在较大浓度的H+、Mg2+
B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1
C.不能确定原溶液是否含有K+、NO3-
D.实验中产生的棕色气体遇空气颜色会加深
难度: 中等查看答案及解析