-
现有下列物质:
①纤维素②甲酸甲酯③淀粉④甲醛⑤丙酸⑥乳酸(α-羟基丙酸)⑦乙二酸⑧乙酸
其中符合Cn(H2O)m的组成,但不属于糖类的是( )
A.②③④⑥
B.②④⑥⑧
C.①③④⑦
D.②④⑤⑧难度: 中等查看答案及解析
-
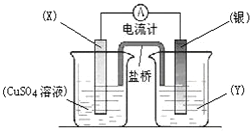
向淀粉中加入少量稀H2SO4,并加热.为了确定淀粉是否已水解或完全水解,所需下列试剂的组合正确的是①NaOH溶液,②银氨溶液,③新制Cu(OH)2碱性悬浊液,④碘水,⑤BaCl2( )
A.①⑤
B.②④
C.②③④
D.①③④难度: 中等查看答案及解析
-
使蛋白质从水中析出并保持其生理活性,可以加入下列溶液中的( )
A.乙酸铅溶液
B.氢氧化钠溶液
C.福尔马林
D.饱和硫酸铵溶液难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.淀粉、纤维素、油脂都属于高分子化合物
B.能发生酯化反应的酸不一定都是羧酸
C.天然蛋白蛋水解的最终产物均为ɑ--氨基酸
D.油脂水解得到的醇是丙三醇难度: 中等查看答案及解析
-
化学反应过程中既有物质变化,又有能量变化.下列判断正确的是( )
A.需要加热才能进行的反应一定是吸热反应,放热反应不需要加热
B.一定条件下进行的化学反应,只能将化学能转化成光能或热能
C.电解质导电的过程实际是一个电解的过程,此过程中电能转化成化学能
D.电镀是利用原电池的原理,在易被腐蚀的金属表面包上一层不易被腐蚀的金属薄片难度: 中等查看答案及解析
-
1克H2燃烧生成液态水,放出142.9KJ热量,则表示该反应的热化学程式正确的是( )
A.H2(g)+O2(g)=H2O(1);△H=-285.8KJ/mol
B.2H2(g)+O2(g)=2H2O(1);△H=-142.9KJ/mol
C.2H2(g)+O2(g)=2H2O(g);△H=-571.6KJ/mol
D.2H2(g)+O2(g)=2H2O(1);△H=+571.6KJ/mol难度: 中等查看答案及解析
-
已知蓄电池在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”.关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时放正极难度: 中等查看答案及解析
-
等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A.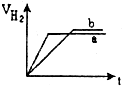
B.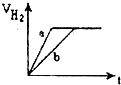
C.
D.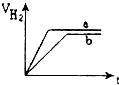
难度: 中等查看答案及解析
-
皮肤的黑白与皮肤中黑色素的多少有关,而酪氨酸是黑色素合成的基础物质,酪氨酸的结构简式为:
,下列有关酪氨酸的说法不正确的是( )
A.酪氨酸分子是手性分子
B.酪氨酸在碱性条件下,主要以阳离子的形态存在
C.水解能生成酪氨酸的蛋白质遇浓酸变黄
D.酪氨酸能发生缩聚反应形成高分子化合物难度: 中等查看答案及解析
-
某同学欲完成2HCl+2Ag═2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
A.
B.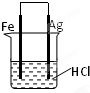
C.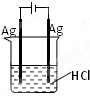
D.难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJ•mol-1
B.反应①中的能量变化如图所示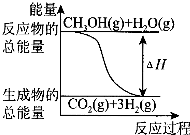
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ
B.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+H2SO4(aq)=
Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol
D.己知C(s)+O2(g)=CO2(g);△H1C(s)+O2(g)=CO(g);△H2 则△H1>△H2
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:
Cd(OH)2+2Ni(OH)2Cd+2NiOOH+2H2O,
有关这个电池的说法正确的是( )
A.放电时的正极反应是:Cd(OH)2+2e-=Cd+OH-
B.放电时的负极反应是:Cd-2e-+2OH-=Cd(OH)2
C.电解质溶液一定是强酸的溶液
D.电池在充电时与负极相连的电极上发生还原反应难度: 中等查看答案及解析
-
近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为:KI+H2O→KIO3+H2↑.下列有关说法中,正确的是( )
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体难度: 中等查看答案及解析