-
有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 ( )
A. HF B. H3O+ C. NaH D. H2O2
难度: 简单查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是( )

难度: 中等查看答案及解析
-
下列各组元素中,电负性依次减小的是 ( )
A. K、Na、Al B. O、Cl、H C. As、P、H D. O、S、Cl
难度: 中等查看答案及解析
-
下列原子中,第一电离能最大的是 ( )
A. B B. C C. Al D. Si
难度: 中等查看答案及解析
-
下列晶体熔化时不需破坏化学键的是 ( )
A、晶体硅 B、食盐 C、固体碘 D、金属钾
难度: 简单查看答案及解析
-
下列能跟氢原子形成最强极性键的原子是 ( )
A、F B、Cl C、Br D、I
难度: 简单查看答案及解析
-
下列物质的分子中,只由σ键形成的是( )
A、氮气 B、甲烷
C、乙烯 D、乙炔
难度: 简单查看答案及解析
-
下列叙述中,错误的是 ( )
A、离子化合物中可能含有非极性键
B、分子晶体中的分子内不含有离子键
C、原子晶体中可能含有非极性键
D、分子晶体中的分子内一定有共价键
难度: 中等查看答案及解析
-
下列对极性分子和非极性分子的认识正确的是( )
A、含非极性键的分子一定是非极性分子
B、含有极性键的分子一定是极性分子
C、双原子极性分子一定含有极性键
D、非极性分子一定含有非极性键
难度: 中等查看答案及解析
-
下列物质性质变化规律正确的是( )
A.金属Na、Mg、Al的硬度依次降低
B.HI、HBr、HCl、HF的沸点依次降低
C.干冰、钠、冰的熔点依次降低
D.O、F、H的原子半径依次减小
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是:( )
A.SO2和SiO2 B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
难度: 中等查看答案及解析
-
有关晶体的下列说法中正确的是( )
A、分子晶体中共价键越强,熔点越高
B、原子晶体中分子间作用力越强,熔点越高
C、氯化钠晶体熔化时离子键发生断裂
D、金属晶体熔化时金属键未发生断裂
难度: 中等查看答案及解析
-
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是 ( )
A.N5+离子中含有36个电
子
B.O2与O4属于同位素
C.C60是原子晶体
D.H2与H3属于同素异形体
难度: 中等查看答案及解析
-
下列各组粒子不能互称为等电子体的是( )
A.CO和N2 B.O3和SO2 C.CO2和N2O D.N2H4和 C2H4
难度: 中等查看答案及解析
-
下列说法正确的是( )
A、1molNa2O2晶体中阴离子与阳离子之比为1:1
B、1molSi晶体中含4molSi—Si键
C、60gSiO2中含Si—O键的个数为4NA
D、12 g金刚石中含有C—C键的个数为NA
难度: 中等查看答案及解析
-
H+离子与NH3分子反应生成NH4+离子,它们之间的相互作用是( )
A、分子间的作用 B、非极性共价键 C、离子键 D、配位键
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B、沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C、用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D、在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 中等查看答案及解析
-
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是( )
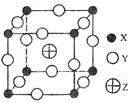
A. ZXY3 B. ZX2Y6
C. ZX4Y8 D. ZX8Y12
难度: 简单查看答案及解析