-
下列说法正确的是( )
A.铅笔芯的主要成分是金属铅
B.CO气体有毒,在生有炉火的居室中多放几盆水,可吸收CO
C.液氯罐中的液氯泄漏时,可将其移入水塘中,并向水塘中加入生石灰
D.夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风难度: 中等查看答案及解析
-
在含有I-离子且滴加酚酞显红色的溶液中,能大量共存的离子组是( )
A.SO42-、NO3-、Fe2+、Al3+
B.Na+、Ba2+、Cl-、AlO2-
C.Cl-、Na+、K+、ClO-
D.NH4+、K+、Cl-、SO32-难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②Fe3O4可写成FeO•Fe2O3;Pb3O4也可写成PbO•Pb2O3
③铝和硫直接化合可以得到Al2S3;铁和硫直接化合也可以得到 Fe2S3
④不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁.
A..①③④
B..②③
C.②③④
D..①②③④难度: 中等查看答案及解析
-
由于碘是卤素中原子半径较大的元素,可能呈现金属性.下列事实能够说明这个结论的( )
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了I2O5等碘的氧化物
C.已经制得了I(NO3)3、I(ClO4)3•2H2O等含I3+离子的化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3-离子难度: 中等查看答案及解析
-
以下能说明氯的非金属性比硫强的事实是( )
①HClO的氧化性比H2SO4的氧化性强; ②常温下氯气是气态而硫是固态; ③氯气能溶于水而硫难溶于水;
④HCl比H2S稳定; ⑤H2S能被Cl2氧化成硫单质; ⑥HClO4酸性比H2SO4强;
⑦氯气与氢气化合比硫与氢气化合要容易进行; ⑧氯的最高价为+7价而硫的最高价为+6价.
A.①②③④⑤⑥⑦⑧
B.①④⑤⑥⑦
C.④⑤⑥⑦⑧
D.④⑤⑥⑦难度: 中等查看答案及解析
-
在元素周期表中,从左到右共有18列.第1列(除氢以外)为碱金属元素,稀有气体是第18列.下列说法中正确的是( )
A.第16列元素都是非金属元素
B.第14列元素形成的化合物都是+4价稳定
C.第3列元素的种类最多
D.第7列元素的化合价有-l价难度: 中等查看答案及解析
-
下列实验报告记录的实验现象正确的是( )
实验 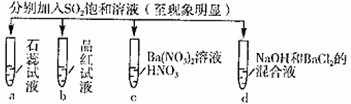
记录 A 无色 无色 无现象 无色溶液 B 红色 无色 白色沉淀 白色沉淀 C 红色 无色 无色溶液 白色沉淀 D 无色 无色 无色溶液 无色溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在一定条件下,16gA和22gB恰好完全反应生成C和4.5gD.在相同条件下,8gA和15gB反应可生成D和0.125molC.从上述事实可推知C的式量为( )
A.126
B.130
C.134
D.142难度: 中等查看答案及解析
-
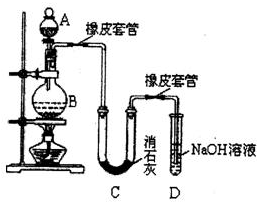
关于下列各装置图的叙述中,不正确的是( )
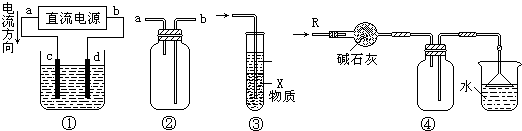
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,(NH3和HCl不溶于CCl4)并可防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3难度: 中等查看答案及解析
-
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0 的化学反应,下列叙述错误的是( )
A.反应过程中能量关系可用图表示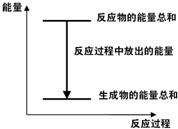
B.若将该反应设计成原电池则锌为负极
C.△H的值与反应方程式的化学计量数有关
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L难度: 中等查看答案及解析
-
有机化合物环丙叉环丙烷,由于其特殊的电子结构一直受到理论化学家的注意,如图是它的结构示意图.下列关于环丙叉环丙烷的有关说法中错误的是( )
A.环丙叉环丙烷的二氯取代物有4种
B.环丙叉环丙烷是环丙烷的同系物
C.环丙叉环丙烷与环己二烯互为同分异构体
D.环丙叉环丙烷所有的碳原子均在同一平面内难度: 中等查看答案及解析
-
进行下列实验肯定不能获得成功的是( )
A.用pH试纸鉴别浓硫酸与浓硝酸
B.用硝酸银溶液区分二氧化氮和溴蒸气
C.用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
D.用溴水除去苯中溶有的少量苯酚难度: 中等查看答案及解析
-
在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是( )
A.54.5%
B.40%
C.36%
D.33.3%难度: 中等查看答案及解析
-
在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.C被还原生成CO难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓
B.用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑
C.利用腐蚀法制作印刷线路板:2Fe3++Cu═2Fe2++Cu2+
D.AgNO3溶液中加入过量氨水:Ag++NH3•H2O=AgOH↓+难度: 中等查看答案及解析
-
已知:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1
H2O(l)=H2O(g)△H2
C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
A.△H3=△H1+4△H2
B.△H3=△H1+△H2
C.△H3=△H1-4△H2
D.△H3=△H1-△H2难度: 中等查看答案及解析
-
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子多1.下列说法正确的是( )
A.元素X、Y的氢化物沸点Y的较高
B.Z元素最高价氧化物对应水化物的化学式可表示为HYO4
C.Y单质可在X的单质存在时燃烧产生化合物YX3
D.离子半径Z>Y难度: 中等查看答案及解析
-
100mL0.1mol•L-1 NaOH溶液与100mL0.1mol•L-1 CH3COOH溶液混合后,溶液中离子浓度关系正确的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)+c(OH-)=c(CH3COO-)+c(H+)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)难度: 中等查看答案及解析
-
一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)⇌2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为mol
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0,升高温度,平衡常数K减小难度: 中等查看答案及解析
-
新型解热镇痛抗炎药扑炎痛的结构如图所示,下列关 于扑炎痛的叙述正确的是( )
A.该物质的分子式为C17H16NO5
B.该物质的核磁共振氢谱上共有8个峰
C.该物质与浓溴水反应生成白色沉淀
D.该物质在酸性条件下水解最终可以得到3种物质难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,以下说法正确的是( )
A.9g水所含电子数为 5NA
B.常温常压下1 mol NO2气体与水在无氧条件下反应生成NA个NO3-离子
C.标准状况下,11.2L三氧化硫溶于水,可生成0.5NA个硫酸分子
D.62 g Na2O溶于水后所得溶液中含有Na+离子数为NA难度: 中等查看答案及解析
-
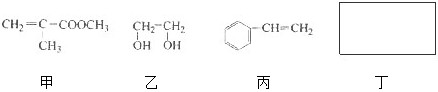
1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广谱、高效、无刺激性、无腐蚀等特点,对禽流感、猪流感等疾病有良好的防治作用.根据上述信息,判断下列说法正确的是( )
A.戊二醛分子式是C5H10O2,符合此分子式的二元醛有4种
B.戊二醛不能在加热条件下和新制的氢氧化铜悬浊液反应
C.戊二醛不能使酸性高锰酸钾溶液褪色
D.2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语中,错误的是( )
A.钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-=4OH-
B.明矾水解的离子方程式:Al3++3 H2O⇌Al(OH)3+3H+
C.少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3一=H2O+CO32-
D.表示氢气燃烧的热化学方程式2H2(g)+O2(g)=2H2O(l);△H=+571.6kJ•mol-1难度: 中等查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
D.充电时每生成1molCH3OH转移6mol电子难度: 中等查看答案及解析
-
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )
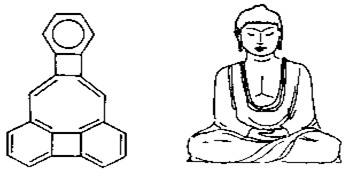
A.该有机物属于芳香烃
B.该有机物属于苯的同系物
C.该有机物分子中含有22个碳原子
D.该该有机物一氯代物只有3种难度: 中等查看答案及解析