-
化学与科技、生产、生活密切相关。下列说法正确的是
A. 目前制备航母拦阻索的材料是尼龙、钢丝,尼龙属天然高分子
B. (NH4 )2HPO4是一种复合肥,可与草木灰混合给作物施肥
C. “可燃冰”是一种高效清洁的新型战略能源,其主要成分为乙烯
D. 用臭氧代替农药在粮食仓储中杀菌防霉,因为臭氧具有强氧化性
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24 L 苯乙烯中含碳碳双键数为0.1NA
B. 4.6 g Na 与足量H2O充分反应,生成气体分子数为0.1NA
C. 0.lmol MnO2与40 g 36.5%的盐酸加热充分反应,转移电子数为0.2NA
D. 1L.0.2 mol/LFeSO4溶液与0.1mol H2O2反应,溶液中Fe3+ 数为0.2NA
难度: 简单查看答案及解析
-
化合物
 (x) 、
(x) 、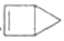 (y)、
(y)、 (z)的分子式均为C5H 6。下列说法正确的是
(z)的分子式均为C5H 6。下列说法正确的是A. x的同分异构体只有y和z 两种
B. y 分子中所有原子均处于同一平面
C. z的二氯代物只有两种(不考虑立体异构)
D. x、y、z均能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
W、X、Y、Z 是原子序数依次增大的短周期主族元素,W 的氢化物水溶液能蚀刻玻璃,X、Y处于相邻位置,Y的最高正价与最低负价代数和为零,W、X 原子的最外层电子数之和与Y、Z 原子的最外层电子数之和相等。下列说法错误的是
A. 原子 半 径 :X> Y >Z >W
B. 最高正价:W>Z>Y>X
C. 简单氢化物的热稳定性:W>Z>Y
D. 简单离子的电子层结构:W 与X相同
难度: 简单查看答案及解析
-
下列有关实验的操作正确的是
选项
实验
操作
A
制备Fe(OH)3胶体
煮沸盛在小烧杯中的25 ml.蒸馏水,加入5~ 6滴饱和FeCl3溶液,继续煮沸至星红褐色
B
配制250 ml.0.1mol/L氢氧化钠溶液
称取1.0 g NaOH 固体放入250 mL容量瓶中,加水至离刻度线1~2 cm处,改用胶头滴管滴入蒸馏水到刻度
C
氢气还原氧化铜
用酒精灯加热盛有灼热的氧化铜的反应管并通入氢气,固体完全变红后,先停止通氢气,然后停止加热
D
除去NaBr溶液中少量的NaI
在溶液中滴入少量AgNO3溶液至不再产生黄色沉淀,然后过滤
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
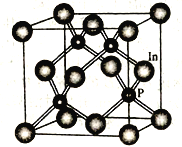
三室式电渗析祛处理废液(HCl 和FeCl2混合溶液)的原理如图所示,其中X、Y均为离子交换膜。在直流电场的作用下,中间室得到盐酸,阴极区可回收铁。下列说法正确的是
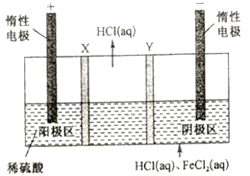
A. X、Y 依次是阴离子透过膜和阳离子透过膜
B. 通电后,阴极区溶液的pH 不断减小
C. 阳极反应式为2H2O-4e-==4H+ + O2 ↑
D. 中间室得到1L 2 mol/L盐酸时,电路中通过1mol电子
难度: 中等查看答案及解析
-
常温时,体积均为50 mL物质的量浓度均为0.10 mol/L 的HX、HY、HZ 三种弱酸,分别用0.10 mol/L 的NaOH溶液滴定,滴定曲线如图所示。下列有关说法错误的是
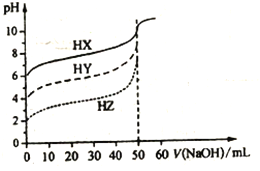
A. 浓度均为0.10 mol/L时,酸的电离度:HX<HY<HZ
B. pH均为3.0的三种酸加水稀释至pH均为6.5,加入水的量:HX>HY>HZ
C. 图中当均滴入50 mL NaOH 溶液时,所得溶液中水的电离程度:HX>HY>HZ
D. 用NaOH溶液中和pH 与体积均相等的三种酸时,消耗n(NaOH):HX<HY<HZ
难度: 简单查看答案及解析




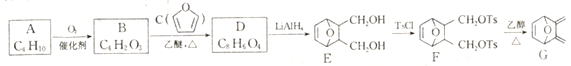
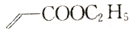 )为原料制备化合物
)为原料制备化合物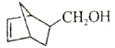 的合成路线:_________________________________________________________(其他试剂任选)。
的合成路线:_________________________________________________________(其他试剂任选)。