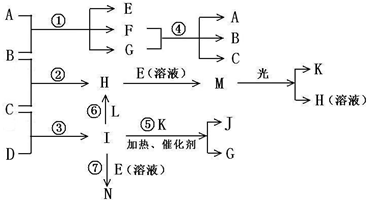
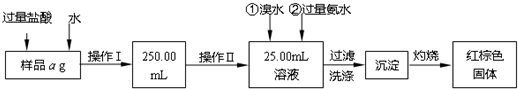
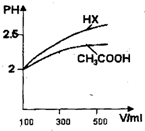
-
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol;②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol;③红磷的化学式为P,白磷的化学式为P4,已知:
P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ/mol
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ/mol下列结论正确的是( )
A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
B.稀硫酸和稀氢氧化钠溶液反应的中和热△H=57.3kJ/mol
C.碳的燃烧热大于110.5kJ/mol
D.稀醋酸和稀氢氧化钠溶液反应生成1mol水,放出57.3kJ/mol热量难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.研究物质的性质,常用观察、实验、分类、比较等方法;研究物质的结构,常利用模型、假说等方法
B.丁达尔现象可用于区别溶液与胶体,云、雾均能产生丁达尔现象
C.纤维素、PLA(聚乳酸)、硝化纤维等都是高分子化合物
D.2010年度诺贝尔化学奖者授予三位美日科学家,他们因研究“有机物合成过程中钯催化交叉偶联”,促进了制造复杂化学物质的可能性,化学家们能在试管中制造了非凡的化学“作品”,说明有机反应全部需要催化剂难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.FeO溶于足量稀HNO3:FeO+2H+═Fe2++H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O
C.将0.1mol•L-1的NH4Al(SO4)2溶液与0.2mol•L-1的Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O
D.CuSO4溶液吸收H2S气体 Cu2++H2S═CuS↓+2H+难度: 中等查看答案及解析
-
麦角醇(ergosterol)在紫外光照射下可转化为抗软骨病的维生素D2,麦角醇的结构为:
下列关于该化合物的说法不正确的是( )
A.可发生取代、加成、氧化等反应
B.分子式为C27H42O
C.1H核磁共振谱证明分子中的4种不同类型的甲基
D.属于芳香族化合物难度: 中等查看答案及解析
-
下列六个说法可以实现的个数是( )
①酸性氧化物在一定条件下均能与碱发生反应;
②弱酸与盐溶液反应可以生成强酸;
③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成;
④两种酸溶液充分反应后,所得溶液呈中性;
⑤有单质参加的反应,但该反应不是氧化还原反应;
⑥两种氧化物发生反应有气体生成.
A.6个
B.5个
C.4个
D.不多于3个难度: 中等查看答案及解析
-
如图是一种可充电的锂离子电池充放电的工作示意图.放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-═LiMnO2(LiMnO2表示含锂原子的二氧化锰)
下列有关说法正确的是( )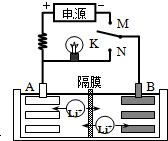
A.该电池的反应式为Li1-xMnO2+LixC6⇌LiMnO2+C6
B.K与M相接时,B是阳极,发生氧化反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充、放电过程中至少存在3种形式的能量转化难度: 中等查看答案及解析
-
可逆反应2SO2(g)+O2(g)
2SO3(g)△H<0在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间关系如图.下列说法中正确的是( )
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)难度: 中等查看答案及解析